Beryllium, das Supergift?

2019 – Jahr des Periodensystems
Am Beryllium und seinen Verbindungen scheiden sich die chemischen Geister. Vermutlich wird mit diesem Element, verglichen mit allen anderen Elementen die mit wenigstens einem nicht-radioaktiven Isotop zur Verfügung stehen, am wenigsten chemisch gearbeitet. Und das, obwohl ganz sicher einzigartige chemische Verbindungen und Eigenschaften ihrer Entdeckung harren. In den letzten Jahren erlebt die Chemie des Berylliums eine kleine Renaissance.
Vorkommen und Eigenschaften
Beryllium kommt in der Natur hauptsächlich in Form der Mineralien Beryll (Be3Al2[Si6O18], Ringsilikat) und Bertrandit (Be4(OH)2[Si2O7], Sorosilicat) vor. Der damals 35-jährige französische Chemiker Louis-Nicolas Vauquelin entdeckte das Element 1798 im Beryll und Smaragd als Berylliumoxid und berichtete ausführlich über die chemischen Unterschiede zum Aluminiumoxid.[1] Er beschrieb den Geschmack von in Schwefelsäure gelöstem Berylliumoxid als anfänglich sehr süß, dann als adstringierend. Selbige Sinneseindrücke gab er von einer Berylliumnitratlösung wieder: „Sa saveur est très-sucrée d'abord, et astringente ensuite“. Vauquelin beendete seinen Bericht damit, dass er noch nicht daran gedacht habe, dem neuen Element einen Namen zu geben bevor er seine Eigenschaften besser kenne, und dass er froh sei, hierfür auch seine Mitbrüder zum Rate zu haben. In einer Anmerkung der Redaktion schlug er den Namen „Glucine“ für das Berylliumoxid vor, den er unter anderem vom griechischen „γλυκυς“, süß, ableitete, und statuierte, dass diese Bezeichnung dem Gedächtnis eine große Stütze sein würde. Metallisches Beryllium wurde dann erstmals von Friedrich Wöhler, sowie unabhängig von Antoine Bussy, im Jahre 1828 dargestellt, indem man BeCl2 mit Kalium reduzierte.[2]
Berylliumverbindungen, -legierungen und das Metall selbst sind in vielerlei Bereichen höchst anwendungsrelevant. Aufgrund seiner geringen Dichte wird Beryllium als Konstruktionsmaterial im Leichtbau für die Luft- und Raumfahrt geschätzt. Berylliumkupfer, eine Legierung mit circa 0,4 bis 2% Berylliumgehalt, ist für die Herstellung von nicht-funkenreißendem und nicht-ferromagnetischen Werkzeugen und Operationsbesteck unersetzlich. Selbst in Golfschlägern und in der Zahntechnik war und ist es sehr beliebt. Vielleicht hat der Leser es sogar im Mund? Berylliumkeramiken für Hochtemperaturanwendungen besitzen eine gute thermische Leitfähigkeit bei enormem elektrischem Widerstand, zudem sind sie weitgehend bruchsicher, was sie in der Summe für Hochspannungs- und Hochfrequenzanwendungen äußerst geeignet macht. Beryllium wird auch zur Sauerstoffentfernung aus Kupfer verwendet, als Neutronenquelle, als Austrittsfenster für Röntgenstrahlen aus den gleichnamigen Röhren sowie in Kernreaktoren als Moderator und Neutronenreflektor.[4, 3]
Die Chemie des Berylliums ist im Vergleich zu den vielfältigen industriellen Anwendungsmöglichkeiten, und im Vergleich zu seinen Nachbarelementen im Periodensystem, völlig unterentwickelt. Möglicherweise rührt dies von der sagenumwobenen Giftigkeit des Elements und seiner Verbindungen her.[5]
„Toxizität“
Seit Jahrzehnten ist das Beryllium als „giftigstes, nicht-radioaktives Element“ bekannt und wird so oft in einem Atemzug mit Plutonium genannt.[5] Zurückzuführen ist dies auf die chronische Berylliumerkrankung (chronic beryllium disease, CBD), bei der es sich um eine chronische Lungenerkrankung ähnlich der Sarkoidose handelt. Die CBD trat und tritt hauptsächlich bei Arbeitern im Be-metallverarbeitenden Gewerbe sowie bei Zahntechnikern auf, die nur geringe Mengen Be-haltigen Staubs einatmeten.[6] Neuere medizinische und biochemische Studien bewerten die „Giftigkeit“ wesentlich realistischer und legen dar, dass die Ursache der CBD auf eine allergische Reaktion oder Autoimmunantwort auf Be2+-Spezies zurückzuführen ist. Wir merken an dieser Stelle zudem an, dass die Humankanzerogenität von Be und seinen Verbindungen nicht zweifelsfrei belegt ist und dass metallisches Beryllium nicht akut toxisch ist.[7] Tatsächlich scheint die „Giftigkeit“ des Berylliums auf eine Überreaktion des Immunsystems zurückzuführen zu sein, was man aus dem Vorhandensein von auf Be2+ empfindlichen T-Zellen in Patienten mit Berylliose geschlussfolgert hat.[8] Die Ursache dieser spezifischen Immunantwort liegt wahrscheinlich an der hohen Affinität des HLA-DP-Proteins für bis dato noch unbekannte Be-Spezies, welches einen Teil des Protein/Petid-Antigenrezeptors auf der Oberfläche der T-Zellen darstellt.[9] Am kristallisierten Protein erhaltende Röntgendaten lassen vermuten, dass die Berylliumspezies im Innern des Proteins gebunden wird und nicht an der Oberfläche präsent ist. Die Bindung von Be führt jedoch zur Änderung der Tertiärstruktur, was dann zur Immunerkennung führen sollte. Die „Giftigkeit“ des Berylliums liegt irgendwo in der Grauzone zwischen allergischer Überempfindlichkeit und Autoimmunreaktion.[9] Anscheinend zeigen nur 1-5% der Allgemeinbevölkerung eine genetische Prädisposition zur Entwicklung der Berylliose (CBD).[11] Dennoch, und vor allem weil die biochemischen Prozesse von Be im Körper unverstanden sind, raten wir eindringlich zu besonderen Schutzvorkehrungen beim Umgang mit Beryllium und seinen Verbindungen.[12]
Allgemeine Trends
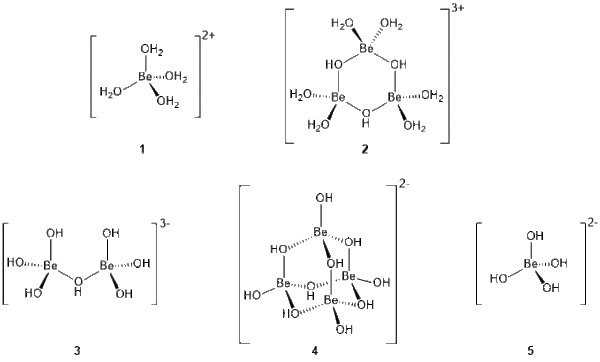
Das Be-Kation wird typischerweise tetraederähnlich von vier Liganden koordiniert, außer der sterische Anspruch des Liganden erzwingt eine andere Koordinationssphäre. Als Beispiele seien das BeF2 (α-SiO2-Strukturtyp), [BeCl4]2−, oder [Be(OH2)4]2+ genannt. Mit sterisch sehr anspruchsvollen Liganden kennt man auch eine trigonal planare (z.B. im [BeEt2]2) und auch lineare (z.B. BetBu2) Koordinationssphäre. In der Gasphase sind einfach-koordinierte Be-Spezies bekannt, zum Beispiel das BeO-Molekül. Bislang kennt man für die Be-Atome in chemischen Verbindungen (mit Ausnahme von vielleicht Legierungen) ausschließlich die Oxidationsstufe +II und 0. Das Be2+-Kation gehört zu den chemisch härtesten Spezies und somit zu den stärksten Lewis-Säuren, sein Ladungs-Radien-Verhältnis Z/r ist 6.45 Å−1. In chemischen Reaktionen gleicht das Beryllium mehr dem Aluminium als dem Magnesium (die wohlbekannte Schrägbeziehung): Beispielsweise sind Be(OH)2 und Al(OH)3 amphoter, Mg(OH)2 zeigt solches Verhalten nicht. Die Ladungs-Radienverhältnisse von Be2+ und Al3+ sind natürlich ähnlich (Al3+: Z/r = 6.00 Å−1). Die meisten chemischen Arbeiten widmeten sich der Koordinationschemie des Berylliums, jedoch lag der Schwerpunkt oft mehr auf der strukturellen Aufklärung der Verbindungen. Deren Reaktivität ist jedoch häufig nur wenig untersucht worden.[13]
Wie bereits erwähnt verhält sich Beryllium in wässriger Lösung amphoter und ist im sauren und stark alkalischen Milieu löslich. Im Bereich von pH = 5.8 – 9 liegt praktisch unlösliches Be(OH)2 vor. Im Bereich von pH = 1 – 4 sind Be-Verbindungen, mit Ausnahme von BeF2 und Verbindungen mit chelatisierenden Anionen, vollständig in Kationen und Anionen dissoziiert. Aufgrund der enorm großen Oxophilie des Be-Kations können nur wenige Liganden mit H2O konkurrieren. Im Sauren liegt so das Be-Kation als tetraedrisch-koordiniertes Tetraaquaberyllium(II)-Kation, [Be(OH2)4]2+, vor (1, Abbildung 1).[13] Im pH-Bereich zwischen 4 – 5.8 bilden sich mehrkernige Komplexe, von denen der bekannteste das sechsgliedrige Ringkation [Be3(µ-OH)3(OH2)6]2+ ist. Mit steigendem pH-Wert führen Kondensationsreaktionen zur Ausfällung von Berylliumhydroxid (pH 5.8 – 9). Im Alkalischen löst sich das Be(OH)2 unter Bildung verschiedener mehrkerniger, hydroxid-verbrückter Anionen auf.[14]
Bei diesen Spezies handelt es sich unter anderem um das hydroxidverbrückte Diberyllat 3, welches auch bei pH-Werten > 11.5 im Gleichgewicht mit dem Tetrahydroxidoberyllat-Anion, [Be(OH)4]2−5, vorliegt, während das abgespaltene OH−-Anion mit einem Wassermolekül ein [HOHOH]−-Anion bildet (Brutto-Gleichung 1).[15]

Obwohl man annimmt, dass das [Be(OH)4]2?-Anion eine Hauptrolle bei sehr hohen pH-Werten spielt, kennt man bislang nur einige wenige Verbindungen, in denen es als solches vorliegt und bislang konnte es strukturell nur anhand der Verbindung Sr[Be(OH)4] mit Hilfe der Röntgenbeugung am Einkristall charakterisiert werden.[16] Für diesen Umstand sind wahrscheinlich Kondensationsreaktionen verantwortlich, denn neben den Beryllaten 3 und 5 konnte auch ein P4O10-artig aufgebautes Decahydroxidotetraberyllium(II)-Dianion 4 im alkalischen Milieu erhalten werden (pH = 13.2).[17] Aufgrund der Vielzahl der in diesem pH-Bereich vorliegenden Spezies hat man vermutet, dass das Gegenkation bei der Kristallisation einen maßgeblichen Einfluss auf die Struktur und Zusammensetzung des Be-Anions hat.[14]
Aktuelle Forschung
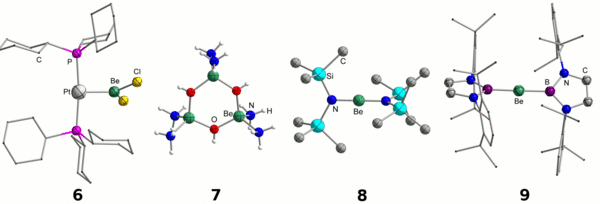
Neben der Untersuchung von einfachen Koordinationsverbindungen [3], beschäftigte man sich mit dem grundlegenden Verständnis des Bindungsverhaltens des extrem harten Berylliumkations. Sein Elektronenmangel erlaubt unter anderem die Ausbildung von dativen Platin-Beryllium-Bindungen, wie anhand von Verbindung 6 gezeigt wird.[18] Die extrem hohe Oxophilie des Be2+-Kations sowie die Tendenz zur Ausbildung von sechsgliedrigen Ringsystemen wird durch den dreikernigen Komplex 7 in flüssigem Ammoniak evident, wenn geringste Mengen an Wasser zugesetzt werden.[19] Die Untersuchung des homoleptischen Amids 8 erlaubte nähere Einsicht in die Be−N-Bindung, welche als vorwiegend ionisch mit partiellem Doppelbindungscharakter beschrieben wird.[20] Durch die hohe Elektrophilie des Berylliums weist auch die Be−B-Bindung im linearen Boryladdukt 9, im Gegensatz zu anderen Elementen des s-Blocks, einen polar-kovalenten Charakter auf.[21]
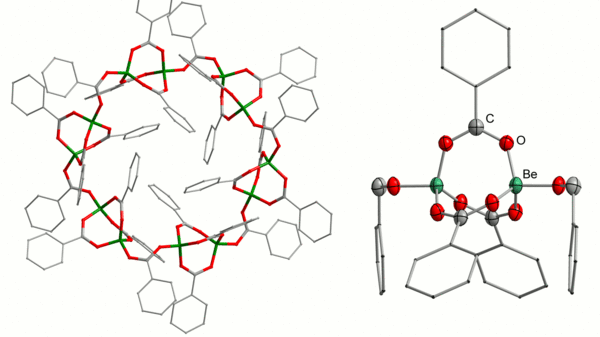
Kürzlich gelang die Synthese des ersten nicht-basischen Berylliumcarboxylates 10, welches aus einem zwölfkernigen Makrozyklus besteht, in welchem jeweils zwei Berylliumatome über drei Benzoateinheiten zu zweikernigen Untereinheiten verknüpft sind. Dieselbe Untereinheit wurde zudem im zweikernigen Komplexsalz 11 gefunden. Durch Untersuchungen von Berylliumverbindungen mit biologisch relevanten, funktionellen Gruppen wurden zudem erste Schritte unternommen, um die Wirkungsweise des Berylliumions im menschlichen Körper auf einer molekularen Ebene zu verstehen.[22]
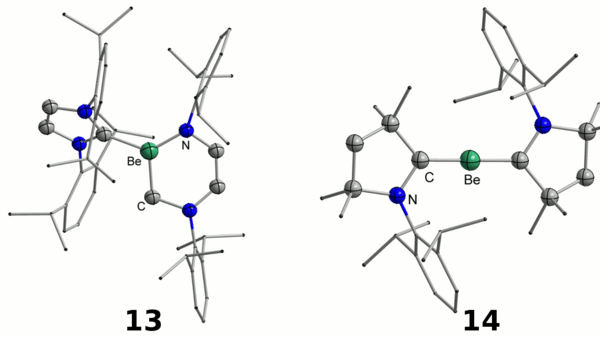
Im ersten strukturell charakterisierten Berylliumazid 12 ist die Be−N-Bindung mit einem ionischen Anteil von 80 % erneut als polar-kovalent anzusehen.[23] N-heterocyclische Carbenaddukte an Berylliumverbindungen reagieren unter Insertion des Berylliumatoms in die C−N-Bindung eines der Carbene unter Bildung von sechsgliedrigen Berylliumheterocyclen 13.[24] Durch die Verwendung von carbocyclischen Aminocarbenen gelang zudem die Synthese eines Beryllium(0)-Komplexes 14. Dies ist das erste Beispiel einer molekularen Verbindung der Gruppe 2, in welcher das Metallatom die Oxidationsstufe Null besitzt.[25] Der hohe Kovalenzanteil in Beryllium−Element-Bindungen ist auch durch die hohe Stabilität des Phosphanadduktes 15 ersichtlich, welches für die sauerstoffatomfreie Synthese von Berylliumorganylen verwendet werden kann.[26]
Literatur
L.-N. Vauquelin, Annales de Chimie 1798, 26, 155-169.
A. Stock, Angew. Chem. 1929, 42, 637-352.
K. Dehnicke, B. Neumüller, Z. Anorg. Allg. Chem. 2008, 634, 2703-2728.
R. Puchta, Nat. Chem. 2011, 3, 416-416.
O. Kumberger, H. Schmidbaur, Chem. unserer Zeit 1993, 27, 310-316.
Institute of Occupational Medicine: IOM, SHEcan Report P937/4, Health, socio-economic and environmental aspects of possible amendments to the EU Directive on the protection of workers from the risks related to exposure to carcinogens and mutagens at work
DGUV-Statistik für die Praxis 2013.
J. Ding, L. Lin, W. Hang, X. Yan, Metallomics 2009, 1, 471-478.
G. Clayton, Y. Wang, F. Crawford, A. Novikov, B. Wimberly, J. Kieft, M. Falta, N. Bowerman, P. Marrack, A. Fontenot, S. Dai, J. Kappler, Cell 158, 132-142.
J. R. Bill, D. G. Mack, M. T. Falta, L. A. Maier, A. K. Sullivan, F. G. Joslin, A. K. Martin, B. M. Freed, B. L. Kotzin, A. P. Fontenot, J. Immunol. 2005, 175, 7029-7037.
IPCS: CICADs Concise International Chemical Assessment Documents, WHO, Genf, seit 1998.
D. Naglav, M. R. Buchner, G. Bendt, F. Kraus, S. Schulz, Angew. Chem. 2016, 128, 10718-10733.
A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie, 102. ed.; Walter de Gruyter: Berlin, New York 2007.
H. Schmidbaur, Coord. Chem. Rev. 2001, 215, 223-242.
M. Schmidt, A. Schier, J. Riede, H. Schmidbaur, Inorg. Chem. 1998, 37, 3452-3453.
B. T. R. Littlefield, C. Hinde, M. T. Weller, Dalton Trans. 2011, 40, 782-784.
H. Schmidbaur, M. Schmidt, A. Schier, J. Riede, T. Tamm, P. Pyykkö, J. Am. Chem. Soc. 1998, 120, 2967-2968.
H. Braunschweig, K. Gruss, K. Radacki, Angew. Chem. 2009, 121, 4303-4305.
F. Kraus, S. A. Baer, M. R. Buchner, A. J. Karttunen, Chem. Eur. J. 2012, 18, 2131-2142.
D. Naglav, A. Neumann, D. Blaser, C. Wolper, R. Haack, G. Jansen, S. Schulz, Chem. Commun. 2015, 51, 3889-3891.
T. Arnold, H. Braunschweig, W. C. Ewing, T. Kramer, J. Mies, J. K. Schuster, Chem. Commun. 2015, 51, 737-740.
M. Müller, M. R. Buchner, Angew. Chem. 2018, 130, 9321 - 9325.
D. Naglav, B. Tobey, B. Lyhs, B. Römer, D. Bläser, C. Wölper, G. Jansen, S. Schulz, Angew. Chem. 2017, 129, 8680 - 8685.
M. Arrowsmith, M. S. Hill, G. Kociok-Köhn, D. J. MacDougall, M. F. Mahon, Angew. Chem. 2012, 124, 2140 - 2142.
M. Arrowsmith, H. Braunschweig, M. A. Celik, T. Dellermann, R. D. Dewhurst, W. C. Ewing, K. Hammond, T. Kramer, I. Krummenacher, J. Mies, K. Radacki, J. K. Schuster, Nat. Chem. 2016, 8, 890 - 894.
M. R. Buchner, M. Müller, S. S. Rudel, Angew. Chem. 2017, 129, 1150 - 1154.

Prof. Dr. Florian Kraus, Dr. Magnus R. Buchner
Fachbereich Chemie, Philipps-Universität Marburg
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Titelbild: Alchemist-hp Be-140g, CC BY-SA 3.0

Kommentare
Martin
am 11.12.2022Der Level, auf dem das hier geschieht, ist allerdings ein ausgesprochen niederträchtiger.
kjs (Redaktion)
am 12.12.2022