Gift oder „immerwährende Pille“ – die Vielfalt von Antimon

Antimon (chemisches Symbol: Sb), der große Bruder des allseits bekannten Arsens, ist ein recht seltenes Element. Trotzdem gibt es seit dem Altertum Anwendungen für das Halbmetall. Besonderes Interesse weckte Antimon jedoch bei den Alchemisten und Heilern im Mittelalter. Und viele Jahrhunderte später machte es durch kuriose Giftmorde von sich reden.
Antimon (Foto oben) ist ein silbergrau glänzendes Halbmetall, das erst bei Erhitzen mit Sauerstoff reagiert. Von großer Bedeutung im Zusammenhang mit dem toxischen Element ist die Marsh`sche Probe, durch die Antimon zum einen zweifelsfrei nachgewiesen und zum anderen auch von Arsen unterschieden werden kann. Sie wurde 1836 von James Marsh entwickelt und für forensische Zwecke genutzt (s. zum Beispiel den Beitrag von Leo Gros in den Nachrichten aus der Chemie). Bis dahin war es nämlich nicht möglich gewesen, Vergiftungen mit Antimon eindeutig zu beweisen.
Die fahlblaue Flammenfärbung zeigt sich auch bei anderen Elementen und beim Nachweis als Sulfid besteht die Möglichkeit einer Verwechslung mit Arsen. Denn ist dieses zugegen, sind orangefarbenes Sb2S3 und gelbes As2Sb3 manchmal gar nicht so leicht zu unterscheiden.
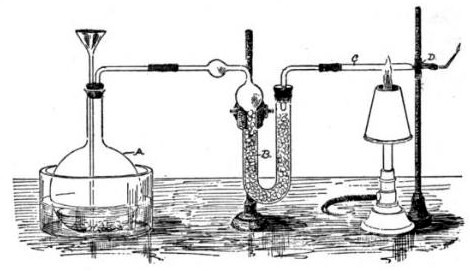
Abb. 1. Versuchsanordnung der Marsh'schen Probe (Illustration: Hugh McMuigan, Marsh test apparatus, Wikimedia Commons, gemeinfrei
Strukturelle Analogie zu Arsen
Antimon kommt in mehreren Modifikationen vor: Das „gewöhnliche“ graue Antimon ist hexagonal-rhomboedrisch und wie bei grauem Arsen bilden sich Doppelschichten aus gewellten Sechsringen aus. Die Struktur ist hexagonal rhomboedrisch. Schwarzes Antimon ist isomorph zu rotem Phosphor bzw. schwarzem Arsen. Es entsteht beim Aufdampfen von Antimon auf gekühlten Flächen. „Explosives“ Antimon ist amorph und glasartig. Man kann es durch Elektrolyse, zum Beispiel von SbCl3 darstellen. Beim Ritzen oder Mörsern geht es explosionsartig in graues Antimon über.
Von Zintl-Phasen bis zu molekularen Verbindungen
Antimon ist ein Halbleiter aus der fünften Hauptgruppe des Periodensystems. Hier, in der Gruppe der Pnicogene, findet der Übergang zwischen den Nichtmetallen, wie Stickstoff und Phosphor, zu den Metallen wie Bismut statt. Daraus ergeben sich spannende Bindungsverhältnisse für viele Verbindungen. Mit Alkalimetallen und Erdalkalimetallen bildet Antimon intermetallische Verbindungen, die von polyanionischen Sb-Baugruppen oder Sb-Netzwerken gekennzeichnet sind. Diese Verbindungen gehören zu den sogenannten Zintl-Phasen.
Auch mit anderen Metallen und Halbmetallen sind zahlreiche Antimon-Verbindungen bekannt. Mit Nichtmetallen hingegen reagiert Antimon zu molekularen Verbindungen und ist hierbei in der Regel der elektropositivere Bindungspartner. Arsen und Antimon weisen sehr kleine Bandlücken auf. Beide Elemente werden häufig in III-IV-Halbleitern verwendet.
Selten, aber gern gebraucht

Abb.2: Antimonsulfid-Kristalle Sb2S3 (Bergminerale/Claas Schembor[1], Antimonit aus Herja 0095w, CC BY-SA 3.0)
In der Natur kommt Antimon sowohl kationisch als auch anionisch und in geringem Maße auch elementar vor. Am häufigsten findet man es in Sulfiden wie dem Grauspießglanz (auch Stibnit oder Antimonit genannt) Sb2S3 und Oxiden wie dem Weißspießglanz Sb2O3. Auch andere, gemischte Sulfide – zum Beispiel mit Arsen – sind bekannt.
Auch wenn Antimon elementar vorkommt, ist es oft mit Arsen vergesellschaftet. Die Gewinnung des Halbmetalls für industrielle Zwecke erfolgt meist aus Stibnit durch Abrösten und anschließender Reduktion mit Kohlenstoff. Das erhaltene Antimon wird dann meist für Legierungen oder in der Halbleitertechnik verwendet. In Legierungen erhöht es die Härte von Blei- oder Zinnlegierungen (s. auch den Beitrag von Carsten von Hänisch hier auf Faszination Chemie).
Schon im Altertum bekannt

Abb. 3. Streichholz (Foto: Sebastian Ritter (Rise0011), Streichholz, CC BY-SA 2.5)
Auch in Gelbpigmenten wie dem Neapelgelb (Bleiantimonoxide), die zum Färben von Keramiken verwendet werden, kommt das Halbmetall vor. Während Antimon(V)sulfid in Munition, Pyrotechnik und in Streichholzköpfen verwendet wird (Abb. 3), dient Antimonoxid als Flammschutzmittelzusatz in Kunststoffen.
Die historische Bedeutung von Antimon ist nicht zu vernachlässigen, auch wenn das Element selten ist. Schon aus seinem Namen lässt sich ableiten, dass es im Altertum bekannt war. So kommen „Antimonium“ und „Stibium“ in der lateinischen Sprache und „Anthemon“ in der griechischen vor. Letzteres bedeutet „Blüte“ und leitet sich wahrscheinlich vom strahlenförmigen Wachstum der Antimonsulfid-Kristalle ab, die in der Tat an eine Blüte erinnern (Abb. 2).
Während Sb2S3 in der amorphen Form orangefarben ist, ist es schwarz, wenn es kristallin vorkommt. Diese kristalline Form wurde in der Antike als Augenschminke verwendet. Auch Augenkrankheiten sollen damit behandelt worden sein. Schon ab 3000 v. Chr. wurde Antimon zudem in Schmuck, in Alltagsgegenständen und zum Färben von Glas und Keramik verwendet.
Eigensinnige Mittelaltermedizin

Abb. 4: Paracelsus (Portrait: Quinten Metsys artist QS:P170,Q4233718,P1877, Q314275, Paracelsus, Wikimedia Commons, gemeinfrei)
In der mittelalterlichen Medizin waren Metalle sehr beliebt. So wurde auch Antimon eine heilende Wirkung zugesprochen. Während andere Metalle wie Silber oder Kupfer durchaus eine gewisse antimikrobielle Wirkung haben, trifft das auf Antimon nicht zu. Übermäßig giftig ist es in elementarer Form aber auch nicht.
Johannes Platearius lobte im 12 Jahrhundert die adstringierende und blutstillende Wirkung des Antimons: „Es hat die Kraft zu lösen und gewaltig auszutrocknen [...], sein Pulver auf den fressenden Krebs getan, ist das beste Mittel für das überflüssige Fleisch. Gegen den Fluß des Blutes aus den Nasenlöchern wird Baumwolle in Sanguinariasaft eingetaucht und Antimoniumpulver in die Nasenlöcher eingebracht“. Welches Pulver das genau war, ist nicht bekannt. Erst 1492 isolierte der Benediktinermönch Basilius Valentinus erstmals elementares Antimon.
Auch Paracelsus (1493-1541) beschrieb in seinem Werk „Große Wundarznei“ von 1536 die innerliche Anwendung von antimonhaltigen Verbindungen als reinigend und verjüngend. Besonders bekannt sind sogenannte „Brechbecher“, in welchen man Wein einige Tage stehen ließ. Danach hatte sich Kaliumantimonyltartrat K2Sb2C8H4O12·3 H2O gebildet, das Erbrechen auslöst. Das gesundheitsschädliche Salz wurde daher Brechweinstein (Abb 5). genannt.
„Immerwährende Pille“
Auch um Fieber zu senken oder Syphilis zu behandeln, wurden Antimonverbindungen eingesetzt. Im ausgehenden 17. Jahrhundert waren mehr als hundert antimonhaltige Mittelchen als Arzneien in Umlauf. Beliebt waren auch Antimonpillen aus oder mit elementarem Antimon, die als Abführmittel dienten.
Ihre Wirkung beruhte unter Umständen allein auf dem Eigengewicht der Pillen, das die Darmperistaltik anregte. Dabei wurden die Metallkugeln mit ausgeschieden und wiederverwertet. Sie sollen sogar von Generation zu Generation weitervererbt worden sein. Der Name „immerwährende Pille“ bringt dies gut zum Ausdruck.
Der Glaube daran, das giftige Substanzen eine reinigende Wirkung haben, hielt sich für das Antimon bis ins ausgehende 18. Jahrhundert, dann waren Antimon enthaltene „Arzneien“ sogar eine Zeitlang verboten. Zur Behandlung von Parasiten wie zum Beispiel bei der Bilharziose werden aber heute noch Sb-haltige Arzneistoffe verwendet.
In der Toxikologie wichtig: die Oxidationszahl
In der Toxikologie ist vor allem das gasförmige Stiban SbH3 von Bedeutung. Es ist hochtoxisch. Das Gas entsteht auch bei der Marsh`schen Probe.
Antimon weist, wie auch einige andere Metalle, eine Affinität zu Thiol-Gruppen von Proteinen auf. Dabei ist aber die Oxidationsstufe entscheidend: Das Hydrid Stiban ist die toxischste aller Antimonverbindungen. Dreiwertiges Antimon reichert sich im Körper an, weil es gut an die roten Blutzellen bindet. Fünfwertiges Antimon verbleibt eher im Blutplasma und wird rascher ausgeschieden.
Die Vergiftungssymptome ähneln stark denen von Arsen-Vergiftungen: Auf der Haut bilden sich Rötungen, Pusteln und Blasen. Nach oraler Aufnahme treten je nach Menge und Art der Verbindung Erbrechen, Durchfall Kraftlosigkeit, Herzschwäche und Herzstillstand ein. Brechweinstein kann für Erwachsene bereits ab einer Dosis von 200 Milligramm tödlich sein. Geringere Gefahr geht von organischen Sb-Verbindungen aus, die meist nur in Spuren Antimon freisetzen und sehr langsam resorbiert werden.
Abb.5. Kaliumantimonyltartrat („Brechweinstein“) (Grafik: Roland.chem, BrechweinsteinV2, CC0 1.0, Wikimedia Commons)
Tödlicher Brechweinstein

Abb. 6: Wolfgang Amadeus Mozart (Barbara Krafft creator QS:P170,Q274815, Wolfgang-amadeus-mozart 1, Wikimedia Commons, gemeinfrei
Erst nach der Erfindung der Marsh`schen Probe konnte man Arsen und Antimon zweifelsfrei und gerichtsfest voneinander unterscheiden. Ob Antimon auch am mysteriösen Tod von Wolfgang Amadeus Mozart im Jahr 1791 beteiligt war, wird wie viele andere Begebenheiten rund um den Tod des Musikers bis heute diskutiert.
Er war im Alter von 35 Jahren während „hitzigem Frieselfiebers“ verstorben, an dem er zuvor schon etwa zwei Wochen lang erkrankt war. Es ist überliefert, dass Mozart „unaufhörlich medizinierte“. Auch der damals beliebte Brechweinstein gehörte zu seinen Hausmittelchen. Dass er versuchte, sein Fieber damit zu behandeln und überdosierte, ist möglich, aber nie bewiesen worden.
Verurteilter Giftmörder

Abb. 7: Giftmörder George Chapman (Quelle: newspaper, George chapman illo, Wikimedia Commons, gemeinfrei)
Anders im Falle von George Chapman, der mit Antimon-Verbindungen, wahrscheinlich Brechweinstein, zwischen 1897 und 1901 in England drei Frauen ermordete. Die ersten beiden Morde blieben zunächst unentdeckt, auf den Totenscheinen der Frauen wurden Tuberkulose und Erschöpfung als Todesursache vermerkt.
Beim dritten Giftmord witterte die Mutter des Opfers Gefahr. Sie hielt Krankenwache am Bett ihrer Tochter, die seit Tagen immer wieder erbrach und zunehmend schwächer wurde. Nachdem die Mutter aus dem Glas ihrer Tochter getrunken hatte, erbrach auch sie. Obwohl sie sofort eine Vergiftung vermutete und schnell reagierte, war es für die Tochter zu spät. George Chapman wurde nach einer Obduktion aller drei Leichen des Dreifachmordes für schuldig befunden und 1903 im Gefängnis erhängt.

Quellen
Hollemann, A. F., Wiberg, E., Wiberg, N., Lehrbuch der Anorganischen Chemie, Auflage 102, Walter de Gruyter, Berlin 2007.
http://ruby.chemie.uni-freiburg.de/Vorlesung/metalle_6.html
Wikipedia „Antimon“ bzw. Antimonpille: https://de.wikipedia.org/wiki/Antimon, https://de.wikipedia.org/wiki/Antimonpille
Jankovic, S., Antimon, Wirtschaftsgeologie der Erze, 297-309, 1967.
Neapelgelb: https://t.ly/TA-qO
Unbekanntes Antimon: https://www.deutschlandfunk.de/unbekanntes-antimon-100.html
Goldenberg, G., Antimon: Bergbau, Metallurgie und historische Verwendung, Archäologische Nachrichten aus Baden, 56: 32-40, 1997.
Heilen mit Antimon: Von der Chemiatrie zur Chemotherapie https://www.pharmazeutische-zeitung.de/titel-10-2000/
Dobler, F., Die chemische Fundierung der Heilkunde durch Theophrastus Paracelsus: Experimentelle Überprüfung seiner Antimonpräparate, Veröffentlichungen der Internationalen Gesellschaft für Geschichte der Pharmazie, Neue Folge 10: 76-86, 1957.
Schwarzmann-Schafhauser, D., Antimonstreit, in: Gerabek, W. E. u. a. (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin und New York 2005
Reuter, F., Methoden der forensischen Beurteilung von Vergiftungen, Urban-Schwarzenberg, Berlin und Wien 1938.
Emsley, J., Mörderische Elemente. Berühmte Todesfälle, Wiley-VCH, Weinheim 2006.
Ludewig, R.: Meinungsstreit über die Ursachen des Todes von W. A. Mozart., Ann. Univ. Sarav. Med. – Suppl.8: 1–92, 1992.
Klinger, C., Kriminalwissenschaftliche Forschungen zu Giften, Giftmorden und Nachweismethoden um 1900, Karl-Franzens-Universität Graz, 2022.
Titelbild: Antimon (Foto: Rob Lavinsky, iRocks.com – CC-BY-SA-3.0, Antimony-201382, CC BY-SA 3.0)

Kommentare
Keine Kommentare gefunden!