Hexastickstoff: Eine neue Verbindung mit großem Potenzial
Wir alle atmen täglich ein Gas ein, das mit 78% den Löwenanteil unserer Atmosphäre ausmacht: Stickstoff. Die chemische Formel von Stickstoff lautet N2, weil immer zwei Stickstoffatome sich zu einem N2-Molekül zusammenschließen.
Abb. 1: Formel von Stickstoff N2 (Yikrazuul, Dinitrogen, Wikimedia Commons gemeinfrei)
Chemisch betrachtet ist dieser gasförmige Stickstoff ein ziemlich toter Hund. Man muss viel Energie reinstecken, damit man die sehr stabile Dreifachbindung zwischen den Stickstoffatomen knacken kann. So etwa beim Haber-Bosch-Verfahren, bei dem Stickstoff und Wasserstoff mit Hilfe eines Katalysators in Ammoniak umgewandelt werden. Mehr zum Stickstoff gibt es in diesem Beitrag hier auf Faszination Chemie.
Während beim Phosphor, einem anderen Element der Stickstoffgruppe, zahlreiche Modifikationen (Allotrope) wie weißer, schwarzer, roter oder violetter Phosphor bekannt sind, wurde bei Stickstoff bislang vergeblich nach weiteren Modifikationen gesucht. Bis jetzt.
Erstmals hergestellt: Hexastickstoff
Denn einer Forschungsgruppe um Prof. Dr. Peter R. Schreiner am Institut für Organische Chemie an der Justus-Liebig-Universität Gießen gelang in diesem Jahr eine wissenschaftliche Sensation. Sie stellten erstmals N6 (Hexastickstoff) her: ein Molekül aus sechs Stickstoffatomen, die linear angeordnet die Form eines großen N ergeben (Abb.2). Bei dieser bislang nur theoretisch vorhergesagten Form von reinem Stickstoff handelt es sich um die energiereichste Substanz, die jemals gebildet wurde. Sie zerfällt rückstandslos zu Stickstoff, dem wesentlichen Bestandteil unserer Atemluft.
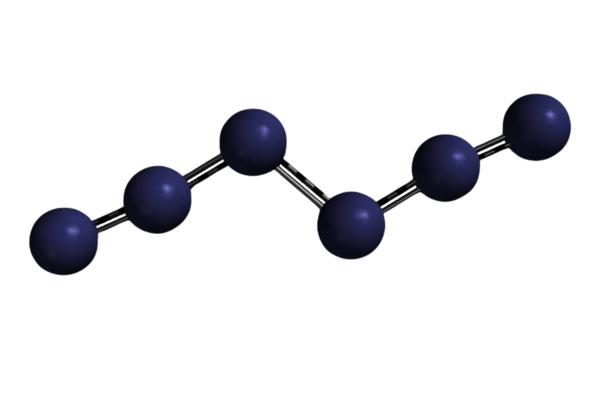
Abb.2: Hexastickstoff (Grafik/Visualisierung: Peter R. Schreiner)
Viel beachtete Veröffentlichung
Besonders stabil ist die Stickstoffvariante nicht, dennoch könnte das neue Molekül die Energiewende vorantreiben, weckt gleichzeitig aber auch das Interesse der Rüstungsindustrie. Schreiners Team arbeitet vor allem an zivilen Anwendungen für Hexastickstoff – etwa als umweltfreundlicher Energiespeicher und nachhaltiger Raketentreibstoff.
Die Veröffentlichung zu N6 im renommierten Journal „Nature“ (Abb.3) sorgte nicht nur in der Wissenschafts-Community für Aufsehen, von „Revolution“ ist die Rede, und manche Experten sprechen sogar von einer nobelpreiswürdigen Entdeckung. Auch in Publikumsmedien stieß die Entwicklung der Gießener Forschungsgruppe auf großes Interesse (s. Video unten auf dieser Seite). Allerdings meist aus einem Grund, der Prof. Schreiner eher unangenehm ist: „Das Interesse der Fachwelt hat mich nicht überrascht. Jeder, der ein molekulares Verständnis hat, kann die Tragweite dieser Erfindung nachvollziehen. Dass es in der populären Verbreitung dann auch so gut ankam, hat mich schon überrascht.“

Abb. 3: Die Veröffentlichung zu N6 im Journal „Nature“ (Weiyu Qian, Artur Mardyukov & Peter R. Schreiner: Preparation of a neutral nitrogen allotrope hexanitrogen C2h-N6, Nature 642, 356-360 (2025) https://www.nature.com/articles/s41586-025-09032-9
„Das freut mich sehr, weil die Chemie oft ganz schlecht in der Öffentlichkeit dargestellt wird. Dass die Öffentlichkeit natürlich auf Überschriften wie ‚stärkster nichtnuklearer Sprengstoff‘ abfährt, ist in der heutigen militärisch geprägten Zeit leider ein notwendiges Übel. Unsere Entdeckung hat aber eine Tür aufgemacht, um weiterzudenken, was man mit Stickstoff noch machen könnte“, sagt der Leibniz-Preisträger von 2024 und nennt zwei sinnvolle Anwendungen: „Wenn wir Hexastickstoff sicher handhabbar machen und hochskalieren können, dann ist das die beste Energiespeichermöglichkeit, die wir uns vorstellen können. Es kann darüber hinaus auch ein fantastischer Raketentreibstoff sein.“
Voraussetzung für die Nutzung: Sichere Handhabung
Bei der Zerlegung von N₆ in normalen Luftstickstoff wird mehr als zwei Mal so viel Energie pro Gramm freigesetzt wie bei TNT – und das ganz ohne umweltschädliche Nebenprodukte. Prof. Schreiner bremst aber die Euphorie für baldige Anwendungen: „Um das Gas als Energiespeicher zu nutzen, muss man es zunächst an feste Materie binden. Dazu sind wir bereits mit Partnern in Gesprächen, die Fachleute sind für Gasspeicherung. Aber da sprechen wir natürlich von Jahren Forschungsarbeit.“
Der Chemiker weiß auch, dass mit der Entdeckung Herausforderungen verbunden sind: „Abgesehen davon, dass N6 bei Raumtemperatur nur eine Lebensdauer von rund 35 Millisekunden hat, ist die Handhabung sehr energiereicher Verbindungen immer mit Risiken verbunden, wenn deren Zersetzung unkontrolliert passiert und alle Energie auf einmal freigesetzt wird“, erläutert er. Neben der Erforschung weiterer, möglicherweise stabilerer Polystickstoffe jenseits von N6 wird es daher vor allem um die sichere Herstellung und Handhabung von Hexastickstoff gehen, um die kontrollierte Umwandlung in Stickstoff zu ermöglichen.
Noch jahrelange Forschungsarbeit notwendig
Über den zeitlichen Horizont macht sich der 59-jährige Wissenschaftler keine Illusionen: „Wir haben einen Forschungshorizont von drei bis fünf Jahren vor uns, wo wir die grundsätzlichen Charakteristika dieses neuen Stoffs so bestimmen können, dass wir sehen können, welche Anwendungen tatsächlich möglich sind.“
Prof. Peter R. Schreiner ist von Hause aus eigentlich der organischen Chemie zugewandt und gilt als ein Vorreiter bei der „grünen“ Chemie. Er gehört zu den Pionieren der Organokatalyse, bei der metallhaltige durch umweltschonende organische Katalysatoren ersetzt werden. „Als Organiker muss man natürlich ein bisschen in sich selbst hineinlachen, wenn man etwas publiziert, das toll ankommt in der Welt und das weder Kohlenstoff noch Wasserstoff enthält. Und dass unsere Erfindung sicherlich Eingang in die Bibel der Anorganik, dem Hollemann-Wiberg finden wird, ist auch etwas Besonderes“, schmunzelt Prof. Schreiner, der schon immer forschender Chemiker werden wollten. „Die Chemie ist sozusagen zu mir gekommen, nicht ich zu ihr. Ich bin der klassische Chemie-Kasten-Set-Chemiker und hatte einen extrem guten Chemielehrer. Die Chemie war immer ein sehr zugängliches Fach für mich. Als Chemiker habe ich mich aber nie in der chemischen Industrie gesehen, sondern wollte immer frei forschen.“
Der richtige Blick aufs Molekül führte zum Ziel
Peter Schreiner sieht die Herstellung von N6 nicht als Entdeckung, vielmehr als Erfindung. Entsprechend sind die Struktur selbst, der Darstellungsweg und die Anwendung patentiert. Und vielleicht bedurfte es erst eines „fachfremden“ Chemikers mit physikalisch-organischen Hintergrund, um eines der größten Rätsel der anorganischen Chemie zu lösen. Die erfolgreiche Synthese der neuen Stickstoff-Modifikation verbindet Schreiner daher auch mit einer wichtigen Kernbotschaft: „Unsere Hauptgruppenforschung zeigt: Es gibt noch ganz viel Grundlegendes zu entdecken. In der Chemie gibt es viele kleine Moleküle, deren Eigenschaften noch nicht ausreichend erforscht sind. Wir haben ganz grundsätzlich eine Tür aufgestoßen. Die war vorher fest versperrt. Da sind viele Leute vorher dagegen gerannt und haben sich eine blutige Nase geholt.“
Der Grund könnte aus seiner Sicht vor allem an der falschen Herangehensweise liegen: „Ich versuche immer, konzeptionell über Moleküle nachzudenken. Nicht über ein spezielles Molekül, sondern eher über Regeln, wie Moleküle sich verhalten. Ich habe mir die Frage gestellt, warum es bisher nicht gelungen ist, N6 zu machen oder ein Stichstoffallotrop jenseits des N2.“ Seine Antwort darauf ist: „Alle haben sich leiten lassen von der Symmetrie und der Schönheit der Moleküle. Man hat bei N4 gedacht, das müsse ein Quadrat oder ein Tetraeder sein. Bei N6 sagten alle, das müsse zyklisch sein wie Benzol.
Das Problem ist, dass in diesen Strukturen instabile N2-Einheiten sitzen. Ich brauche diese nur durch eine symmetrische, zentrische Streckung ein bisschen auseinanderziehen und das Molekül zersetzt sich sofort. Mein Gedanke war, dass alle Verbindungen mit erkennbaren Stickstoffpaaren einfach nicht stabil genug sein würden und schnell wieder zerfallen, weil der Stickstoff in seine Lieblingsform zurückwill. Deshalb wurde bislang auch noch kein N₄ hergestellt. Im N₆ aber arrangieren sich die Stickstoffatome linear in zwei Dreiergruppen – stabil genug, um nachweisbar zu sein.“
Forscherteam musste beweisen, dass es kein Messfehler ist
Die Herstellung des Supermoleküls klingt zunächst relativ einfach. Sie erfolgt durch eine Gasreaktion von Silberazid (AgN3 ) mit Halogenen wie Chlor oder Brom bei Raumtemperatur. „Die Synthese erfordert aber eine präzise Steuerung der Reaktionsbedingungen, insbesondere die Kontrolle der Temperatur und des Drucks, um die Bildung von N₆ zu ermöglichen und seine Zerbrechlichkeit zu minimieren. Dabei ist darauf zu achten, die Reaktion in einer kontrollierten Umgebung durchzuführen und die entstehende Verbindung sofort in bei sehr niedrigen Temperaturen, etwa bei minus 269 °C, einzufangen“, beschreibt Prof. Schreiner.
Vor der Veröffentlichung musste das Team, zu dem außer Schreiner noch Dr. Artur Mardyukov und Weiyu Qian vom Institut für Organische Chemie der JLU gehören, nachweisen, dass es sich wirklich um Hexastickstoff und nicht etwa um einen Messfehler handelt. Das Team konnte das Molekül mit verschiedenen Methoden nachweisen.
Zur Messung der Lichtabsorption nutzten die Chemiker eine Kombination von Infrarot- und UV/Vis-Spektroskopie. „Wir wussten natürlich, das ist kein Dreck. Zum Beweis mussten wir aber Isotopen-markiertes Silberazid selber herstellen und das ist wirklich anstrengend. Das Isotopenmuster hat im Infrarot aber perfekt mit der Berechnung übereingestimmt“, erinnert sich Prof. Schreiner mit Stolz an den Moment des endgültigen Nachweises von Hexastickstoff.
Für den Forscher ist diese Synthese ein wichtiger Meilenstein für die Hauptgruppenelement-Forschung: „Die Hauptgruppenchemie ist doch nicht ganz so gut erforscht wie gedacht. Aber da nun auch andere Arbeitsgruppen unseren Syntheseweg nachmachen können, dürfte relativ viel Neues passieren in nächster Zeit. Konkurrenz ist in der Grundlagenforschung unglaublich wichtig. Es ist immer toll zu sehen, wenn andere Ideen reinkommen, und man sich sagt, warum hast du da nicht selber dran gedacht? Das finde ich wahnsinnig befruchtend“, ist Prof. Peter Schreiner sehr gespannt auf weitere Forschungsergebnisse.
Klimawandel, Ernährung, Medizin – Herausforderungen können nur mit Chemie gelöst werden
Der vielfach ausgezeichnete Wissensvermittler will daher auch die junge Generation ermutigen, Naturwissenschaften zu studieren. „Wenn ich daran interessiert bin, zu verstehen, wie die Natur funktioniert, dann muss ich die Naturwissenschaften studieren. Allen voran diejenige, die die molekulare Ebene betrachtet, die Chemie. Und alle Probleme, die wir heute betrachten, können nur mit, nicht ohne oder gar gegen die Chemie gelöst werden: Klimawandel, Ernährung, Medizin. Das sind die großen Herausforderungen. Und das geht nur mit Chemie. Ich finde es furchtbar, dass viele Leute nicht verstehen, wie unglaublich wichtig unser Fach ist. Und ich sage denen immer, die Chemie ist so lange schlecht, bis man in die Apotheke rennt und dann froh ist, dass es irgendwas gibt, was einem hilft.“
Naturwissenschaft zum Wohl der Menschen einsetzen
Für den Gießener Chemieprofessor und ehemaligen GDCh-Präsidenten ist entscheidend, die Erkenntnisse aus den Naturwissenschaften zum Wohl der Menschen einzusetzen und dabei in der Forschung Wege zu gehen und Möglichkeiten auszuloten, an die bisher noch niemand gedacht hat. „Für mich geht es am Ende der Wissenschaft immer darum, wie Neues in die Welt kommt. Wie kann ich mich zwingen, so zu denken, wie kein anderer gedacht hat. Ich kenne viele Leute, die über viele Themen sehr viel wissen und dann trotzdem keine großen Entdeckungen machen. Weil sie sagen, das hat schon vor 30 Jahren jemand probiert und das ging nicht. Das ist total abwegig. Wir wussten bei Hexastickstoff gerade genug, dass wir eins und eins zusammenzählen konnten und am Ende gesagt haben, jetzt probieren wir das einfach. Ich glaube, es ist wichtig, dass man immer wieder an den Rändern des eigenen Fachs schaut und mutig mit produktivem Halbwissen Versuche durchführt, die manchmal erfolgreich sind.“
Vorbild: Justus von Liebig

Abb. 5: Namensgeber der Universität Gießen, Justus von Liebig
Justus von Liebig NIH, Wikimedia Commons gemeinfrei
Deswegen sieht er auch den „Vater der Organischen Chemie“ und Namensgeber der Universität Gießen, Justus von Liebig, als ein Vorbild für seine Chemiker-Generation. „Formal habe ich den Liebig-Lehrstuhl. Und natürlich ist Liebig ein großes Vorbild in ganz vielerlei Art und Weise. Er hat Forschung und Lehre als Kanon betrachtet, und er hat immer verstanden, die Chemie auch publik zu machen. Er hatte durch Öffentlichkeitsarbeit etwa mit seinen Abendvorlesungen immer das Publikum gesucht. Er war extrem kreativ und mutig und hat sich von der vorherrschenden Lehre nicht behindern lassen. Er wollte die Naturwissenschaften zum Wohl der Menschen einsetzen. Und hat genau das auch gemacht. Er hat Kunstdünger erfunden. Er hat die Wissenschaft benutzt, um das Leben der Menschen zu verbessern.“
Und möglichweise gelingt genau dies auch Prof. Schreiner und seiner Forschungsgruppe mit der grundlegenden Erfindung des Hexastickstoffs.

Bedeutung der Synthese von Hexastickstoff
• Es handelt sich nicht nur um eine „chemische Kuriosität“, sondern um Grundlagenforschung, die eine neue Tür in der Stickstoff-Chemie aufgestoßen hat.
• Nachhaltige Anwendungen: Hexastickstoff als sauberer Energiespeicher und effizienter Raketentreibstoff– bei Freisetzung entsteht nur Luft, somit keine Schadstoffe.
• Wie bei vielen energiereichen Stoffen (z. B. Ammoniumnitrat) besteht auch bei N₆ ein Dual-Use-Potenzial (Chemie-Dualismus): Nützliche Anwendungen (z. B. Energie) stehen möglichen militärischen Missbräuchen (z. B. Sprengstoff) gegenüber.
• Die Forschung steht am Anfang. In den nächsten drei bis fünf Jahren will das Team um Prof. Schreiner die Eigenschaften von N₆ vollständig charakterisieren und mögliche Anwendungen testen.
Publikation
Weiyu Qian, Artur Mardyukov & Peter R. Schreiner:
Preparation of a neutral nitrogen allotrope hexanitrogen C2h-N6, Nature 642, 356-360 (2025)
https://www.nature.com/articles/s41586-025-09032-9
Diesen Beitrag als pdf ausdrucken!


Kommentare
Keine Kommentare gefunden!