Indium – selten und wichtig

2019 – Jahr des Periodensystems
Vorkommen und Gewinnung
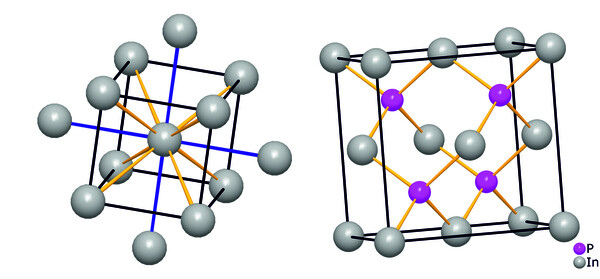
Indium wurde relativ spät im Jahre 1863 durch Ferdinand Reich und Theodor Richter an der Bergakademie in Freiberg (Sachsen) als Bestandteil einer Zinkerz-Probe entdeckt. Seine charakteristische indigoblaue Spektrallinie im Linienspektrum ermöglichte nicht nur seine Entdeckung, sondern verhalf ihm auch zu seinem Namen. Kurze Zeit später wurde es in reiner Form durch Reduktion seines Oxids mit Holzkohle gewonnen. Erst 1933 fand es breitere Anwendung als Schutzüberzug von Metallen und zur Generierung von niedrig schmelzenden Legierungen und ist heute insbesondere für die elektronische Industrie ein essentieller Rohstoff. Indium ist selten, die Häufigkeit seines Auftretens in der Erdkruste entspricht ungefähr derjenigen von Silber oder Quecksilber. Indiumhaltige Mineralien (z. B. FeIn2S4) finden sich nur sehr begrenzt, es wird daher im Wesentlichen als Nebenkomponente aus Zinksulfid oder anderen Erzen gewonnen. Der Gehalt dieser Erze an Indium beträgt durchschnittlich nur etwa 100 ppm. Der Preis für Indium ist entsprechend hoch und beträgt zurzeit etwa 350 Euro/kg mit Potential nach oben. Die Weltjahresproduktion liegt bei ca. 770 Tonnen. Die Struktur des Metalls (Abb. 1) lässt sich als tetragonal innenzentriert mit vier kurzen (blau, 325 pm) und acht längeren In-In-Abständen (gelb, 337 pm) beschreiben.
Anwendungen
Moderne Aspekte der Anwendung von Indiumverbindungen finden sich vor allem im Bereich der Elektronik oder Kommunikationstechnik, Mobiltelefone enthalten einige Milligramm an Indium. Ein wichtiger Punkt ist die Erzeugung von III-V-Halbleitern, bestehend aus Elementen der dritten und fünften Hauptgruppe des Periodensystems, die über eine von der Zusammensetzung abhängige, leicht modulierbare Bandlücke zwischen Valenz- und Leitungsband und damit veränderliche elektronische Eigenschaften verfügen. InP, InAs, aber auch ternäre oder quaternäre Phasen wie In1-xGaxN sind Beispiele für solche Materialien. [1] Sie werden in der Hochfrequenztechnik, in Lasern, Leichtdioden oder in integrierten Schaltkreisen eingesetzt. Ihre Strukturen leiten sich im Allgemeinen von der Sphalerit-Struktur (Zinkblende, Abb. 1, rechts) ab, in der die Atome jeweils tetraedrisch umgeben sind. Ihre Synthese erfolgt durch Abscheidung aus der Gasphase unter drastischen Bedingungen, beispielsweise unter Zersetzung von metallorganischen Vorläufermolekülen wie InMe3.
Ein weiteres wichtiges Material (80% der Indiumproduktion) ist Indium-Zinn-Oxid (ITO), das durch Dotierung von In2O3 mit ca. 10% Zinn erhalten wird. [2] Die Ionenradien von In3+ und Sn4+ sind ähnlich, so dass sich beide Ionen in den Gittern gegenseitig vertreten können. ITO wird als transparentes und elektrisch leitendes Material beispielsweise für die Herstellung von Flüssigkristallbildschirmen, Touchscreens oder Dünnschichtsolarzellen eingesetzt.
Bemerkenswerte Variabilität der Oxidationsstufen
Die wichtigen Oxidationsstufen von Indium in chemischen Verbindungen sind +I und +III. Nach dem allgemeinen Trend in den Hauptgruppen nimmt die Stabilität der niederen Oxidationsstufe beim Übergang zu den schwereren Elementen zu, so dass für Indium in anorganischen Verbindungen beide Stufen ungefähr gleichberechtigt sind. Elementares Indium reagiert beispielsweise mit Brom zu farblosem InBr3, das in der Schmelze mit Indium unter Komproportionierung zu rotem InBr mit einwertigen Indiumatomen reagiert. [3] Beide Verbindungen besitzen im Festkörper ionische Strukturen, sind thermisch sehr beständig und lassen sich im Vakuum ohne Zersetzung sublimieren. Die Metallatome von In2Br4 besitzen interessanterweise nicht die nach einfachen Regeln abzuleitende Oxidationsstufe +II, sondern sind gemischt-valent mit beiden beständigen Oxidationsstufen in einer Verbindung, InI[InIIIBr4]. [3] Daraus lassen sich mit überschüssigen Halogenidionen X- die Anionen [X3In-InX3]2- erzeugen, in denen die Indiumatome über eine In-In-Bindung miteinander verbunden sind und die Oxidationsstufe +II aufweisen. [3]
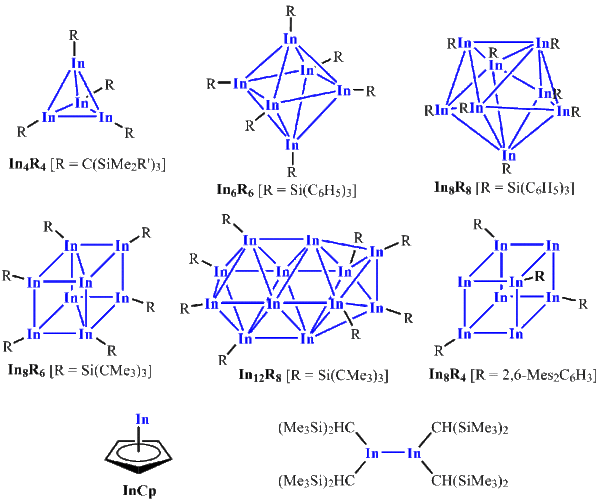
In der metallorganischen Welt verändern sich die Stabilitäten der Oxidationsstufen im Einklang mit Beobachtungen für andere Hauptgruppen. Alkyl- und Arylindium(III)-Verbindungen sind leicht unter Salzmetathese aus InX3 und MRn-Reagenzien (M = Li, Mg, Al) oder durch Umsetzung von In/Mg-Legierungen mit Alkylhalogeniden zugänglich. Wie mit den schweren Elementen üblich, ist die In-C-Bindung instabil [4], und man beobachtet bei thermischer Belastung Zersetzung unter Abscheidung des Metalls. Mit InMe3 verläuft diese Zersetzung oberhalb von 100 °C explosionsartig. Dennoch ist es ein technisches Produkt und wird in reiner Form zur Synthese von III-V-Halbleitern eingesetzt. Anders als in der anorganischen Chemie sind metallorganische Verbindungen mit einwertigem Indium hochgradig unbeständig und zersetzen sich bereits weit unterhalb von Raumtemperatur spontan unter Disproportionierung. Daher wurden nur wenige sterisch hoch abgeschirmte metallorganische Verbindungen mit Indium in Oxidationsstufen zwischen +I und 0 bekannt. [5] Sie besitzen spektakuläre Strukturen mit In-In-Wechselwirkungen und Clustern aus Indiumatomen (Abb. 2) und entstehen bei der Umsetzung von In(I)-Halogeniden mit Lithiumorganylen oder durch Reduktion von Alkyl- oder Arylindiumdihalogeniden mit Alkalimetallen. Die In-In-Wechselwirkungen sind mitunter so schwach, dass in Lösung Dissoziation zu monomeren Bruchstücken InR erfolgt, die über ihr freies Elektronenpaar als Liganden gegenüber Übergangsmetallatomen fungieren. [6] Lange bekannt sind monomere Verbindungen, in denen In(I) an einen Cyclopentadienylring gebunden ist (Abb. 2). [6] Hier trägt wohl die Sättigung der In-Atome durch die seitlich gebundenen Cyclopentadienyl-Ringe zur Stabilisierung bei. Man kennt auch einige metallorganische In(II)-Verbindungen mit In-In-Einfachbindungen [4], auch sie erfordern eine hohe sterische Abschirmung, um kinetisch den Zerfall unter Disproportionierung zu unterbinden (Abb. 2).
Somit zeigt sich Indium als ein flexibles Element mit vielseitigen chemischen Eigenschaften, die zur Bildung außerordentlich ungewöhnlicher Verbindungen, aber auch zu seiner Anwendung in der modernen Technologie beitragen.
Literatur
M. O. Manasreh (ed.), InP and Related Compounds - Materials, Applications and Devices, Gordon and Breach, 2000.
H. Kim, C. M. Gilmore, A. Piqué, J. S. Horwitz, H. Mattoussi, H. Murata, Z. H. Kafafi, D. B. Chrisey, J. Appl. Phys. 1999, 86, 6451.
W. Uhl, M. Layh: Formal Oxidation State +II: Metal-Metal Bonded Versus Mononuclear Derivatives; in: The Group 13 Metals Aluminium, Gallium, Indium and Thallium - Chemical Patterns and Pecularities (Ed. S. Aldrigde, A. J. Downs), Wiley, 2011, S. 246.
C. Elschenbroich, Organometallchemie, 4. Aufl., Teubner, Stuttgart, 2003, S. 24.
W. Uhl, A. Jantschak, W. Saak, M. Kaupp, R. Wartchow, Organometallics 1998, 17, 5009; N. Wiberg, T. Blank, H. Nöth, W. Ponikwar, Angew. Chem. Int. Ed. 1999, 38, 839; N. Wiberg, T. Blank, A. Purath, G. Stößer, H. Schnöckel, Angew. Chem. Int. Ed. 1999,
C. Jones, A. Stasch, The Chemistry of the Group 13 Metals in the +1 Oxidation State; in: The Group 13 Metals Aluminium, Gallium, Indium and Thallium - Chemical Patterns and Pecularities (Ed. S. Aldrigde, A. J. Downs), Wiley, 2011, S. 285.

Prof. Dr. Werner Uhl
Institut für Anorganische und Analytische Chemie, Westfälische Wilhelms Universität Münster
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Titelfoto: Dschwen, Indium wire, CC BY-SA 3.0

Kommentare
Keine Kommentare gefunden!