"Ja Kalzium, das ist alles!"

2019 – Jahr des Periodensystems
Völlig gleich, ob es sich um das Lesen dieses Beitrages handelt, den ultimativen Genuss eines exquisiten Glases Rotwein oder gar das Erlebnis der Aromenvielfalt einer edlen kubanischen Zigarre: Ohne Calcium geht nichts! Geringste Konzentrationsänderungen von Ca2+ innerhalb unserer Zellen sind die Grundlage für all unsere Sinne, unsere Bewegungen und das Funktionieren unseres Gehirns.Es war der in Frankfurt geborene Otto Loewi, der 1959 das inzwischen viel zitierte "Ja Kalzium, das ist alles!" ausrief. Loewi (1873-1961) entdeckte 1921 an der Universität Graz die chemische Weiterleitung von Nervenimpulsen und erhielt 1936 zusammen mit Henry Dale den Nobelpreis für die Entdeckung der Neurotransmitter. Obwohl Neurotransmitter wie Acetylcholin rein organisch sind, bewirken elektrische Nervenimpulse kurzzeitige Calciumströme, die letztendlich die Ausschüttung der Botenstoffe aus Vorratsspeichern regulieren. Die extrem vielseitige Rolle von Calcium als lebenswichtiges Element ist heute durch eine große Zahl an biochemischen Rollen belegt, wie beispielsweise Bildung von sowohl harten als auch weichen Strukturen, intrazelluläre Prozesse, Signalübertragungen und als Kofaktor für eine Vielzahl von Proteinen und Enzymen .[1]
Vorkommen
Calcium gehört zu den häufigsten Elementen der Erde und ist mit 3,4% nach Fe und Al das dritthäufigste Metall in der Erdkruste.[2] Aufgrund seiner niedrigen Elektronegativität findet man es in der Natur ausschließlich in kationischer Form (Ca2+) als Carbonat, Sulphat, Silicat, Phosphat oder Fluorit. Die schwere oder nahezu völlige Wasserunlöslichkeit der meisten Calciumsalze ist mit ein Grund, warum gigantische Gebirgsketten aus Calciumerzen bestehen. Auch die Tatsache, dass Calcium in Form von Zement ganze Gebäude zusammenhält und Bausubstanz für viele Biomaterialien wie Skelette, Muscheln und Zähne bildet, ist hierauf zurückzuführen.
Calcium kommt meist als CaCO3 in der Form von Calcit (Kalkstein oder Kalkspat, Marmor, Kreide oder Muschelkalk) vor, seltener als Aragonit oder das sehr seltene Vaterit. Besonders rein ist der auf Island vorkommende Kalkspat, auch Doppelspat genannt, weil er eindrucksvoll das Phänomen der Doppelbrechung zeigt und daher zur Herstellung von Prismen benutzt wird (beispielsweise das zur Polarisation genutzte Nicolsche Prisma). Die reversible Umsetzung des wasserunlöslichen Calciumcarbonats in das wasserlösliche Calciumbicarbonat, CaCO3 + H2O + CO2 ⇄ Ca(HCO3)2, ist nicht nur die Grundlage für prächtige Tropfsteinbildungen, sondern auch für hohe wirtschaftliche Schäden in Form von Kalkablagerungen in Wasserrohren, Haushaltsgeräten und diversen Anlagen.
Auch als CaSO4∙2H2O (Gips) gibt es große natürliche Calciumvorkommen, die in verschiedenen, wunderschönen Erscheinungsformen auftreten können, wie beispielsweise das Marienglas (auch bekannt als Selenit, Frauenglas oder Spiegelstein) oder die Wüstenrose. Die größten und eindrucksvollsten Selenitkristalle mit bis zu 14 Metern Länge findet man in der "Cueva de los Cristales" (Naica, Mexico), einer menschenfeindlichen Höhle fast 300 Meter unter der Erdoberfläche. Die größeren Kristalle sind über einen Zeitraum von 1 Million Jahre gewachsen [3]. Extreme Bedingungen wie hohe Temperatur (45-50 °C) und Luftfeuchtigkeit (90-100 %) verhindern das Verdunsten von Schweiß und erfordern daher für den Menschen spezielle Schutzmaßnahmen. Obwohl Kristalle normalerweise spröde sind und sich leicht spalten, aber nicht wie Metalle biegen lassen, sind Gipskristalle (Selenit) überraschend biegsam. Deshalb kommt Selenit in der Natur auch als stark gebogene Gipslocke vor. Heutzutage wird Gips nicht mehr abgebaut, sondern hauptsächlich durch Rauchgasentschweflung produziert.

Da Gips fast überall reichlich vorkommt, war er nie ein umstrittener Rohstoff. Diese weitgehende machtpolitische Bedeutungslosigkeit führte zum Sprichwort „Erzähl mir nichts vom Gipskrieg“, um jemandem auf ironische Art und Weise klarzumachen, dass man nicht über etwas spricht, das es nicht gibt.[4] Im weitesten Sinne gilt dies auch für das Element Calcium. Es ist weltweit überall verfügbar, und daher gibt es keine Monopole auf dieses häufige, weitverbreitete Metall.
Entdeckung und Eigenschaften
Joseph Black (1728-1799), der Entdecker des Kohlendioxids aus dem schottischen Edinburgh, konnte zeigen, dass beim Brennen von CaCO3 ein neues, leichteres weißes Pulver und CO2 entstehen.[1] Da es unmöglich war, den gebrannten Kalk (CaO) weiter zu zersetzen, wurde er fälschlicherweise für ein Element gehalten. Das Element Ca in seiner metallischen Form konnte wie so viele der elektropositiveren Elemente erst nach der Entdeckung der Elektrizität isoliert werden. Humphrey Davy (1778-1829), ein Begründer der modernen Chemie und Professor für Chemie an der Royal Institution in London, gelang es erstmals, durch Elektrolyse von geschmolzenen Salzen Alkali- und Erdalkalimetalle darzustellen, und isolierte so 1808 metallisches Calcium. In sehr reiner Form bildet Calcium kubische Kristalle mit ausgeprägtem Metallglanz und leichtem Gelbstich. Heutzutage wird Calcium meist durch ein aluminothermisches Verfahren hergestellt: 4 CaO + 2 Al → 3 Ca + CaAl2O4 .[2] Die Reduktion von CaO mit H2 gelingt nicht, und Versuche, es mit Kohlenstoff zu reduzieren, ergeben das synthetisch wichtige CaC2.
Metallisches Ca reagiert nur schwach mit Wasser unter H2-Bildung und verbrennt an der Luft zu CaO und Ca3N2. Es löst sich wie die Alkalimetalle in Ammoniak mit tiefblauschwarzer Farbe als Ammoniakat Ca(NH3)6, welches beim Aufkonzentrieren der Lösung goldglänzende Kristalle bildet.
Anwendung
Historisch gesehen liegt die Gewinnung von CaCO3 und CaSO4∙2H2O schon Tausende von Jahren zurück. Das beim Brennen entstehende CaO oder das kristallwasserfreie (oder -arme) CaSO4 waren schon immer eine wichtige Bausubstanz und sind auch heute noch in der Baustoffindustrie nicht mehr wegzudenken. Die wohl bekannteste Spezialanwendung für CaSO4 als medizinischer Gips ist unter anderem auf die leichte Verarbeitung, die schnelle Trocknung und die passend klinisch-weiße Farbe zurückzuführen. Die unübliche Biegsamkeit der Gips-Kristalle (siehe oben) spielt sicherlich auch eine entscheidende Rolle beim Tragekomfort von solchen Gipsverbänden, die wesentlich elastischer sind als Beton. Heutzutage ist der Gipsverband weitgehend durch Kunststoffschienen ersetzt worden, wobei die Steifheit dieser Schienen durch rasche Entwicklungen in der Polymerchemie maßgeschneidert werden konnten.
Eine schnellwachsende Forschungsrichtung ist die der Biomineralisierung. [5] Einfache Ca-basierte Biomineralien bestehen oft aus komplexen Strukturen mit einer sehr präzisen architektonischen Ordnung über einen großen Skalenbereich. Ihre beeindruckende Architektur ist verantwortlich für die ausgezeichnete Stabilität und Belastbarkeit, die diejenige von synthetischen Materialien übertrifft. Das Geheimnis der überlegenen Eigenschaften liegt in der organisch-anorganischen Hybridstruktur. Zum Beispiel ist Perlmutt, welches zu 95% aus Aragonit (CaCO3) besteht, circa 3000 mal belastbarer als das brüchige Aragonit selbst. Die Synthese von Biomineralien ist stark abhängig von einer biologischen Komponente wie Biomakromolekülen, welche die Mineralisierung und den Aufbau regulieren. Es ist von höchster Bedeutung, die Mechanismen, die zur Bildung von erwünschten und unerwünschten Biomineralien führen, zu verstehen.
Hundert Jahre nach der Entdeckung der Grignard-Magnesium-Reagenzien entwickelt sich jetzt auch die Calciumorganyl-Chemie. Diese junge, stark wachsende Forschungsrichtung bietet interessante Perspektiven in der Polymerchemie oder der Katalyse. [6] Der Grund, warum die Calciumorganyl-Chemie lange im Dornröschenschlaf lag, ist vor allem auf den schwierigen synthetischen Zugang zu hochreaktiven CaR2-Verbindungen (R = Alkyl oder Aryl) zurückzuführen. Das Problem der Ca-Grignard Synthese, R-X + Ca →R-Ca-X (X = Cl, Br, I), liegt häufig in der niedrigen Reinheit und Oberflächenreaktivität des Ca-Metalls, aber auch in der sehr hohen Reaktivität von R-Ca-X selbst. Dies führt zu Zersetzungsreaktionen wie etwa Ether-Spaltung oder Wurtz-Kupplung: R-Ca-X + R-X → R-R + CaX2.
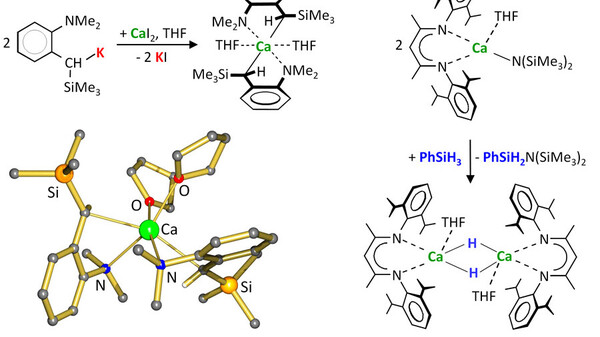
Die Synthese von wohldefinierten, hochreaktiven Benzylcalciumverbindungen gelang durch die Reaktion von reinen Kaliumbenzyl-Vorstufen mit CaI2, eine Reaktion die als Salz-Metathese bekannt ist. Heutzutage kann man auch in bestimmten Fällen Ca-Grignard-Verbindungen synthetisieren und isolieren. [7] Wichtig ist eine effiziente Aktivierung des Ca-Metalls, niedrige statt hohe Reaktionstemperaturen und Arylhalogenide als Substrat, um Wurtz-Kupplung zu minimieren. Synthetischer Zugang zu hochreaktiven Ca-Organylen erlaubten ihren Einsatz als Katalysatoren in der lebenden und stereoselektiven Styrolpolymerisation und später auch in der Alkenhydrosilylierung und –hydrierung, wo Calciumhydrid-Intermediate eine Schlüsselrolle in der Katalyse spielen. Auch die Alkenhydroaminierung, -hydrophoshinierung und -hydroborierung sowie eine Vielzahl anderer Reaktionen können heutzutage Ca-katalysiert ablaufen. Obwohl Ca nicht über substrataktivierende d-Orbitale verfügt, gibt es ein schnellwachsendes Einsatzgebiet für derartige Erdalkalimetall-Katalyse. Aufgrund des niedrigen Preises und der Ungiftigkeit von Ca-Katalysatoren gewinnt die Calcium-Katalyse immer mehr an Bedeutung. Neben der beschränkten Toleranz für funktionelle Gruppen sind noch weitere Hürden zu überwinden, aber die Ca-(und abgeleitete Mg, Sr oder Ba)Katalyse stellt eine attraktive Alternative zu den Edelmetall-Katalysen dar. In diesem relativ jungen Forschungsgebiet sind auch in den nächsten Jahrzehnten viele spannende Entwicklungen zu erwarten.
Literatur
A. K. Campbell, Intracellular Calcium, John Wiley and Sons, 2015.
A. F. Holleman, N. Wiberg, Lehrvbuch der Anorganischen Chemie 102. Auflage, 2007, Walter de Gruyter, Berlin.
A. E. S. Van Driessche, J. M. Garcia-Ruiz, K. Tsukamoto, L. D. Patino-Lopez, H. Satoh, PNAS 2011, 108, 15721.
T. Hofmeier Achtung Gipser. 100 Jahre Grassi & Co. AG in Basel. 2. Aufl. Books on Demand, Norderstedt 2009, S. 16.
(a) M. Epple, Biomaterialien und Biomineralisation - Eine Einführung für Naturwissenschaftler, Mediziner und Ingenieure, Teubner Verlag 2003. (b) H. Cölfen, Nature Materials 2010, 9, 960.
(a) S. Harder, Chem. Rev. 2010, 110, 3852. (b) A. G. M. Barrett, M. R. Crimmin, M. S. Hill, P. A. Procopiou, Proc. R. Soc. A2010, 466, 927. (c) M. R. Crimmin, M. S. Hill, Topics in Organometallic Chemistry, Ed. S. Harder, 2013, vol. 45, p. 191.
(a) R. Fischer, M. Gärtner, H. Görls, M. Westerhausen, Angew. Chem. Int. Ed. 2006, 45, 609. (b) M. Westerhausen, J. Langer, S. Krieck, R. Fischer, H. Görls, M. Köhler, Topics in Organometallic Chemistry, Ed. S. Harder, 2013, vol. 45, p. 29.

Prof. Dr. Sjoerd Harder, Dr. Christian Färber
Anorganische und Metallorganische Chemie Universität Erlangen-Nürnberg, Anorganische und Metallorganische Chemie Universität Erlangen-Nürnberg
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.

Kommentare
Keine Kommentare gefunden!