Zink – Ein universelles Metall

2019 - Jahr des Periodensystems
Name und Eigenschaften
Zink (Zn) ist ein natürlich vorkommendes Element mit der Ordnungszahl 30 im Periodensystem der Elemente, dessen Name sich von Zinke „Zacke“ ableitet und auf das zackenförmige Erstarren zurückzuführen ist. Es ist ein bläulich-weißes Metall, welches trotz seiner Zuordnung zu den Übergangsmetallen in seinen chemischen Eigenschaften aufgrund der abgeschlossenen d-Schale starke Ähnlichkeit zu den Erdalkalimetallen aufweist. Vom Zink sind insgesamt 29 Isotope bekannt, wobei 64Zn (48,63 %) 66Zn (27,90 %) und 68Zn (18,75 %) die drei häufigsten sind. Zink kristallisiert in einer verzerrten hexagonal-dichtesten Kugelpackung und ist bei Zimmertemperatur und oberhalb von 200 °C relativ spröde, während es zwischen 100 und 200 °C jedoch duktil und leicht formbar ist. Zink reagiert an der Luft unter Ausbildung einer Schicht aus Zinkoxid und Zinkcarbonat (Passivierung), so dass es trotz seines unedlen Charakters (Redoxpotential -0.763 V) als Korrosionsschutz beim Verzinken von Eisen- und Stahl breite technische Anwendung findet. Besonders reaktiv ist Zinkpulver, welches sich spontan an der Luft entzündet kann. Zink liegt in seinen Verbindungen fast ausnahmslos in der formalen Oxidationsstufe +II vor, wobei in neuester Zeit sogenannte niedervalente Zinkverbindungen, in denen die Zinkatome in der formalen Oxidationsstufe +I vorliegen, besonders intensiv untersucht werden.
Biologische Bedeutung
Zink ist ein für alle Lebewesen essentielles Spurenelement sowie Bestandteil wichtiger Enzyme (RNA Polymerase) und Zinkfingerproteine. Zudem nimmt es Schlüsselrollen im Zucker-, Fett- und Eiweißstoffwechsel sowie beim Zellwachstum ein. Zink wird insbesondere beim Verzehr von roten Fleischsorten, Käse, Weizen, Walnüssen, Pilzen, Linsen und Meeresfrüchten aufgenommen. Ein Zinkmangel kann zu Wachstumsstörungen, Haarausfall und Blutarmut führen. Die Weltgesundheitsorganisation WHO empfiehlt die tägliche Aufnahme von 10-15 mg Zink pro Tag, während Dosen von mehr als 200 mg Übelkeit und Erbrechen hervorrufen können. Bei Aufnahme sehr hoher Dosen kann es zudem zu grippeähnliche Symptome mit zum Teil starken Fieberanfällen kommen (Zinkfieber).
Vorkommen, Strukturen und Technische Gewinnung
Zink ist das 24. häufigste Element in der Erdkruste (0,0076 %). Es kommt (selten) in gediegener Form sowie in gebundener Form (Zinkerze) vor, insbesondere als Zinksulfid ZnS wie Wurtzit oder Sphalerit. Große Lagerstätten wurden in Nordamerika, Australien oder der Volksrepublik China erschlossen, und auch in Deutschland wurden Zinkerzlagerstätten im Harz, Sauerland sowie im Rheinland ausgebeutet. Im Messinghof (Kassel) wurde Galmei (die Bezeichnung für verschiedene Zinkerze) bereits seit 1679 verhüttet. Zur Herstellung von elementarem Zink werden die Zinksulfiderze zunächst an der Luft zu Zinkoxid geröstet, welches anschließend entweder mit Kohle vermischt und bei 1100-1300 °C zu elementarem Zn reduziert wird (trockenes Verfahren; Röstreduktion) oder in verdünnter Schwefelsäure gelöst und elektrolytisch reduziert wird (nasses Verfahren). Im Ruhrgebiet entstanden die ersten Zinkhütten 1845 in Mülheim an der Ruhr, 1847 in Essen-Borbeck und 1854 in Oberhausen.

Verwendung – früher und heute
Bereits im Altertum war Zink als Legierungsbestandteil von Messing in Gebrauch, während es als isoliertes Metall erst im 17. Jahrhundert in Indien, zweihundert Jahre vor den Europäern, entdeckt wurde. Messing wurde bis Ende des 18. Jahrhunderts aus natürlich vorkommendem Zinkcarbonat ZnCO3, welches gemeinhin als Smithsonit, Zinkspat, edler Galmei oder Edelgalmei bezeichnet wird, durch Reaktion mit Kupfer (Zementation) hergestellt. Während metallisches Zink historisch aufgrund seiner Korrosionsstabilität in verschiedenen Gebrauchsgegenständen (Gießkannen, Bleche, Rohre, Besteck, Münzen, ...) sowie in Zinkdruckplatten für künstlerische Druckverfahren Verwendung fand, wird es heutzutage in großen Mengen in der Bauindustrie, der Architektur, der Automobilproduktion sowie im Maschinenbau eingesetzt. Weltweit wurden im Jahr 2013 rund 13 Millionen Tonnen Zink gewonnen, wovon die Hälfte im Korrosionsschutz bei der Verzinkung von Eisen und Stahlteilen (Feuerverzinken, galvanische Verzinkung, mechanische Verzinkung, ...) verwendet wird. Etwa 23 % werden für die Herstellung von Halbzeugprodukten wie dem als Dacheindeckung, Fassadenbekleidung (z.B. Fassade des Jüdischen Museum Berlin sowie der Libeskind-Villa in Datteln) und für die Dachentwässerung verwendeten Titanzinkblech sowie Gusserzeugnisse verwendet und 17 % gehen in die Messingproduktion.[1] Zudem wird Zink in nicht wiederaufladbaren Batterien (Zink-Luft, Zink-Kohle, ...) und in wiederaufladbaren Batterien (Akkumulatoren) verwendet. Hervorzuheben ist, dass Zink heutzutage aus seinen Haupteinsatzbereichen zu fast 100 % ohne Qualitätsverlust recycelt wird.
Das vielseitige technische Potential von Zink zeigt sich gerade im Automobilbereich sehr eindrucksvoll. Nach Angaben der International Zinc Association (IZA) werden in einem PKW ca. 10,2 kg Zink verwendet, vorzugsweise im Korrosionsschutz (3 kg) und in Zinkdruckgussbauteilen (4,9 kg) sowie in geringeren Mengen auch im Reifengummi, Auswuchtgewichten oder in Farben. Neue Anwendungsbereiche wie beispielsweise Overhead-Displays, in denen Zinkoxid-Nanopartikel, die einerseits transparent sind und andererseits Strom schneller leiten als andere Werkstoffe in herkömmlichen Displays, farbige Bilder auf die Windschutzscheibe und damit ins direkte Blickfeld des Fahrers projizieren, sind bereits absehbar.
Bedeutung von Zink in der aktuellen chemischen Forschung
In der organischen Chemie findet elementares Zink als Reduktionsmittel Verwendung, insbesondere bei der Reduktion von Carbonylverbindungen, Allylalkoholen und aromatischen Nitroverbindungen. Zudem findet Zink aufgrund seiner Eigenschaft, Diiodmethan unter Bildung eines Zinkcarbenoids zu aktivieren, Anwendung in der Cyclopropanierung von Alkenen (Simmons-Smith Reaktion).
Eine wichtige anorganische Zinkverbindung ist Zinkoxid, ein direkter Halbleiter mit einer Bandlücke von 3.2–3.4 eV, der UV-Licht absorbiert und für sichtbares Licht transparent ist und dessen elektrische Leitfähigkeit zudem durch Dotierung (Fremdatomeinbau z.B. Al, B) erhöht werden kann. ZnO findet insbesondere bei der Herstellung von Dioden, Flüssigkristallbildschirmen (TFT) und Dünnschicht-Solarzellen Verwendung. Zudem wird es in piezoelektrischen Wandlern, Sensoren, Leuchtdioden oder Optoelektronik- und Spintronik-Bauelementen verwendet. Darüber hinaus hat ZnO medizinische Anwendungen bei der Wundbehandlung (Zinksalben und -pflaster „Leukoplast"). Neben Zinkoxid hat Zinkacetat, welches in Kaugummi als Geschmacksverstärker eingesetzt wird (E650), eine gewisse kommerzielle Bedeutung. Zinkacetat wird gut vom Darm in die Blutbahn resorbiert und kann als Zinklieferant für den Organismus dienen.
Die erste bekannte metallorganische Zinkverbindung ist das bereits 1848 von E. Frankland durch Reaktion von Zink mit Ethyliodid hergestellte Zinkdiethyl ZnEt2.[2] Aufgrund des pyrophoren Charakters von ZnEt2 musste Frankland hierzu unter CO2 als Schutzgas arbeiten. Die im Vergleich zu Grignard-Verbindungen (RMgX), Lithiiumorganylen (LiR) und Aluminiumorganylen (AlR3) weniger nukleophilen zinkorganischen Verbindungen zeichnen sich durch ihre höhere Selektivität aus. Diethylzink wird in der organischen Synthese sehr vielfältig eingesetzt, da es eine Vielzahl von funktionellen Gruppen toleriert. Zudem findet es technische Verwendung in der Solarindustrie zur Herstellung von TCO-Schichten aus ZnO für Dünnschicht-Solarzellen.
Von bisher eher akademischem Interesse sind niedervalente Zinkverbindungen, deren erster Vertreter, das Dizincocen Cp*2Zn2, 2004 von Carmona et al. synthetisiert wurde.[3] Seitdem wurden zahlreiche weitere Verbindungen dieses Typs synthetisiert, strukturell charakterisiert und ihre Reaktivität untersucht.[4]
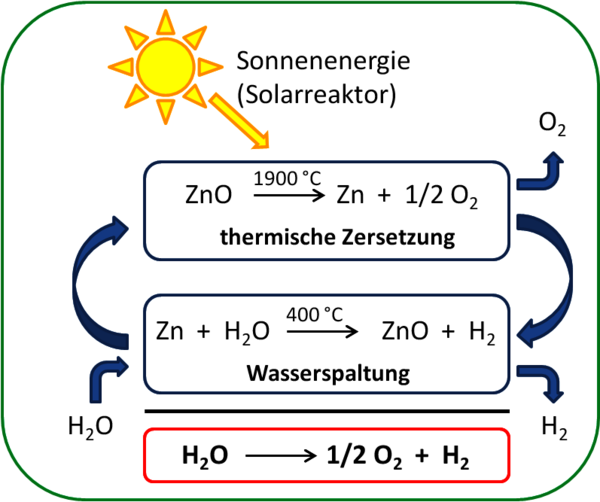
Ein ganz neues Anwendungspotential offenbart sich für Zink in der Wasserstofftechnik. Während im Labormaßstab hierzu typischerweise die Reaktion von Zinkgranalien mit Salzsäure herangezogen wird, werden in einem aktuellen Forschungsprojekt (Solzinc) solarchemische Reaktoren zur solaren Herstellung von Zink (Zn) entweder durch thermische Zersetzung von ZnO bei hohen Temperaturen oder durch karbothermische Reduktion von ZnO zur Wasserstoffherstellung bei niedrigeren Temperaturen entwickelt. Ausgehend von Zinkoxid ZnO wird mittels Sonnenenergie unter Zusatz von Kohlenstoff Zink hergestellt, welches dann mit H2O zu ZnO und H2 reagiert. Ein weiteres aktuelles Forschungsthema liegt in der Entwicklung von wiederaufladbaren (sekundären) Zink-Luft Batterien, die als Energiespeicher nicht zuletzt für regenerativ erzeugten Strom Verwendung finden können.
[1] http://www.initiative-zink.de
[2] D. Seyferth, Zinc Alkyls, Edward Frankland, and the Beginnings of Main-Group Organometallic Chemistry, Organometallics 2001, 20, 2940–2955.
[3] I. Resa, E. Carmona, E. Gutierrez-Puebla, A. Monge, Decamethyldizincocene, a Stable Compound of Zn(I) with a Zn-Zn Bond, Science 2004, 305, 1136–1138
[4] T. Li, S. Schulz, P. W. Roesky, Synthesis, reactivity and applications of zinc–zinc bonded complexes, Chem. Soc. Rev. 2012, 41, 3759.

Prof. Dr. Stephan Schulz
Institut für Anorganische Chemie, Universität Duisburg-Essen
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Titelfoto: Hp.Baumeler, Zink Mine Rosh Pinah (Namibia), CC BY-SA 4.0

Kommentare
Ferdinand Schneider
am 04.12.2019kjs (Redaktion)
am 04.12.2019