Ionische Polymere, Ionomere und Polyelektrolyte

100 Jahre Makromolekulare Chemie
Ein Chemiker, der von Ionen hört, verortet das Objekt bzw. Thema wahrscheinlich intuitiv zuerst einmal in die anorganische oder die Komplexchemie. Doch besonders spannend wird es, wenn sich Ionen und Makromoleküle in ionischen Polymeren „zusammenraufen".
Verschiedene ionische Polymere
Das Gold Book der International Union of Pure and Applied Chemistry (IUPAC) unterscheidet im Wesentlichen zwei der ionischen Polymertypen. [1] Dies sind zum einen die „Polyelektrolyte", in denen der überwiegende Anteil der Wiederholungseinheiten ionische oder ionisierbare Gruppen trägt; zum anderen die „Ionomere", in denen dies nur auf einen kleinen (meist unter 10 %), jedoch signifikanten Anteil der Wiederholungseinheiten zutrifft. Charakteristisch ist für beide Polymerklassen, dass sich in ihnen starke und langreichweitige elektrostatische Wechselwirkungen mit typischen Polymereffekten überlagern, wie sie sich aus der schieren Größe von Makromolekülen sowie der chemisch fixierten Bündelung der Bausteine auf molekularer Ebene ergeben.
Eigenschaften
Eine Besonderheit ionischer Polymere ist, dass nur ein Teil der ionischen Gruppen kovalent im Polymer gebunden sein muss. Niedermolekulare Gegenionen können diese Gruppen neutralisieren. Während im Festkörper Kationen und Anionen eng zusammensitzen, führt dies z.B. in Lösung zu hybriden Phänomen: Die kleinen Gegenionen können sich entropisch günstig über das gesamte System verteilen, die innerhalb der einzelnen Makroionen befindlichen Ladungen aber nicht. Letztere bleiben auf molekularer Ebene hochkonzentriert (Abb. 1). Zusammen führen die diversen Wechselwirkungen zu ungewöhnlichen, teils einzigartigen physikalischen Strukturen und Eigenschaftsprofilen, die man oft als „Polyelektrolyt-Effekte" bezeichnet.
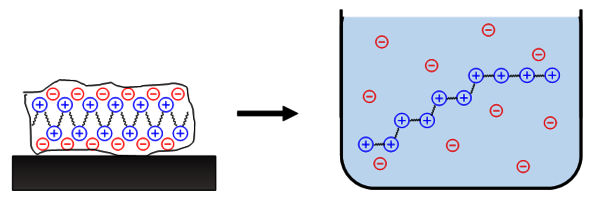
Abb.1: Verteilung polymergebundener (im Beispiel Kationen, blau) und niedermolekularer (im Beispiel Anionen, rot) Ionen beim Lösen. © André Laschewsky
Wie bereits festgestellt, ist im einfachsten Fall in der chemischen Struktur nur eine Sorte von geladenen Gruppen kovalent an das Polymergerüst gebunden. Man erhält so Polykationen (Abb. 2A) oder Polyanionen (Abb. 2B). Natürlich können auch alle beide Sorten geladener Gruppen kovalent fixiert sein (nicht unbedingt in gleicher Zahl). Diese Makromoleküle bezeichnet die IUPAC als Polyampholyte (Abb. 2C). Im Extremfall sind die ionischen Gruppen immer paarweise in den Wiederholungseinheiten platziert (Abb. 2D). Bei diesen Polymere spricht man von Polyzwitterionen oder von polymeren inneren Salzen.[1]
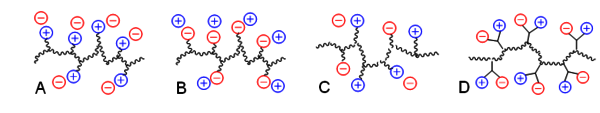
Abb.2: Untergruppen ionischer Polymere © André Laschewsky
Kein unbekanntes Phänomen
Erste Polyelektrolyte wurden bereits Ende der 1920er Jahre von Staudinger synthetisiert, speziell die Polyacrylsäure und ihre Salze, [2] die bis heute als Paradebeispiel der Stoffklasse gelten. In den 1940er und 50er Jahren führte die Arbeitsgruppe des US-amerikanischen Chemikers Raymon M. Fuoss Pionierarbeiten zum physikalisch-chemischen Verhalten der Polyelektrolyte durch. [3] Auch um das theoretische Verständnis wird schon lange gerungen.[4,5]
Und dennoch haben Polyelektrolyte und Ionomere bis heute nichts an ihrer Faszination verloren. Ihre strukturelle Vielfalt ist enorm, [6] wobei sich die polymergebundenen und niedermolekularen Ionen unabhängig voneinander verändern lassen. Letztere lassen sich naturgemäß besonders einfach variieren. Aufgrund dieser Vielfalt, den speziellen Polyelektrolyteffekten sowie den großen Schwierigkeiten in der adäquaten theoretischen Beschreibung bieten Ionomere und Polyelektrolyte eine großartige „Spielwiese" gleichermaßen für die Theorie, neue Stoffe und neue Phänomene. Dies trifft auch für praktische Anwendungen zu.
Auch in der Praxis gefragt
Denn ionische Polymere sind nicht nur spannende Forschungsobjekte, sondern bilden auch die stoffliche Grundlage für vielseitige Materialien bzw. essentielle Hilfsstoffe. Dies gilt in besonderem Maße für wässrige Systeme. Als Bestandteile von Hydrogelen, Superabsorbern, Ionenaustauschern, Wasserenthärtern, Viskositätsreglern, Bohrschlämmen, Flockmitteln, Haarspray oder Löschmitteln sind ionische Polymere nicht mehr wegzudenken – genauso wenig wie bei der Papierherstellung, wässrig entwickelbaren Photolacken, elektrochemischen Lackierverfahren, tertiärer Ölgewinnung oder Mikroverkapselung wässriger Systeme. Man nutzt Polyelektrolyte und Ionomere auch als Bestandteil von Hightech-Systemen, wie z.B. Membranen für Brennstoffzellen, leitfähige Polymere oder bei der Herstellung von Anoden für Lithium-Akkumulatoren.
Ionische Polymere in der Natur
Und auch die Natur macht von den besonderen Eigenschaften der ionischen Polymere Gebrauch. Ohne diese gäbe es kein Leben: sowohl Nuklein- und Teichonsäuren also auch viele Polysaccharide, von Chitosan, Alginaten und Pektin bis zu Hyaluronsäure, Chondroitinsulfat und Heparin, sind Polyelektrolyte. Weiterhin stellen die meisten Proteine Ionomere bzw. Polyampholyte dar. Entsprechend spielen biogene wie biobasierte bzw. -inspirierte ionische Polymere in Medizin und Lebensmitteltechnologie eine große Rolle. Bezeichnend ist die enorme Bandbreite der chemischen Strukturen und der wahrgenommenen Funktionen. Diese versucht man zusätzlich durch die Modifizierung von a priori ungeladenen Biopolymeren – wie Cellulose, Stärke oder Lignin – mit ionischen Gruppen zu erweitern. Nicht zu vergessen ist, dass in der unbelebten Natur ionische Polymere ebenfalls verbreitet vorkommen. So sind Polyphosphat und viele Alumosilikate „Klassiker" der anorganischen Polyelektrolyte, während Graphenoxid einen „modernen" Vertreter darstellt.
Medizinisch relevant
In den letzten Jahren haben sich auch Polyzwitterionen (Abb. 2D), die lange als Kuriosum angesehen wurden, zu einem wachsenden Forschungsgebiet entwickelt. Wegen ihrer meist hohen Hydrophilie bei Fehlen einer Nettoladung scheinen derartige Polymere besonders gut biologisch verträglich zu sein. Damit werden sie nicht nur für Medizinmaterialien attraktiv. Sie zeigen in wässrigen Systemen außerdem extrem niedrige Reibungskoeffizienten und sind weitgehend inert gegen unspezifische Adsorption. Dies macht sie u.a. für die Entwicklung von blutverträglichen oder Antifouling-Materialien und zur Stabilisierung von Proteinen, z.B. in der Biotechnologie oder der Sensortechnik, interessant.
Aktuelle Forschungsansätze
Weiterhin versucht man zunehmend, Funktion in ionischen Polymeren durch kombinatorische Ansätze mittels spezifischer Gegenionen zu erreichen. So lassen sich relativ einfach und sehr variabel z. B. homogene Blends von Polyelektrolyten und niedermolekularen Salzen herstellen (Abb. 3A), stabile Polyanion-Polykation-Komplexe (sogenannte "Symplexe", Abb. 3B) synthetisieren, oder Komplexe aus Polyelektrolyten und ionischen Tensiden oder Farbstoffen erhalten (Abb. 3C).
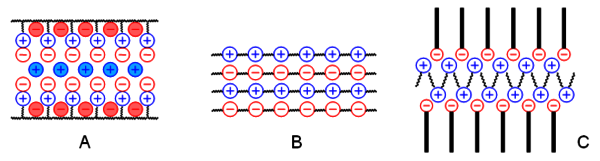
Abb.3: Neue Materialen aus ionischen Polymeren durch Kombination mit funktionellen Gegenionen. © André Laschewsky
Sogenannte Poly(ionische Flüssigkeiten) ("poly(ionic liquid)s") zählen ebenfalls dazu. Bei ihnen baut man unkonventionelle, in der Regel chemisch inerte niedermolekulare Gegenionen ein, um neue Eigenschaften zu erzielen. Die mittlerweile viel verwendete Bezeichnung ist allerdings irreführend, da die Polymere nicht den Aggregatzustand der Monomerbausteine konservieren (niemand würde Polyolefine als Polygase oder Vinylpolymere als Polyflüssigkeiten bezeichnen). Weil die typischerweise voluminösen Gegenionen meistens recht hydrophob sind, bieten solche Polymere einen günstigen Zugang zu wasserbeständigen kohlenstoffarmen bzw. heteroelementreichen Polymermaterialien mit ungewöhnlichen Strukturen und Eigenschaften.
Auch nach hundert Jahren Polymerforschung, wie wir sie dieses Jahr feiern, ist also kein Ende zu sehen. Es bleiben viele spannende Dinge zu entdecken, zu lernen und zu tun, nicht zuletzt bei den ionischen Polymeren.
Autor: Prof. Dr. André Laschewsky (Universität Potsdam und Fraunhofer Institut für Angewandte Polymerforschung (IAP))
Redaktionelle Bearbeitung: Lisa Süssmuth, GDCh
Literatur
[1] IUPAC. Compendium of Chemical Terminology, 2nd ed. (The "Gold Book").
[2] H. Staudinger, E. Urech, Helv. Chim. Acta 1929, 12, 1107-1133.
[3] R. M. Fuoss, Discuss. Faraday Soc. 1951, 11, 125-134.
[4] P. G. de Gennes, Scaling Concepts in Polymer Physics. Cornell University Press (1979), Ithaca (New York).
[5] S. Förster, M. Schmidt, M. Antonietti, J. Phys. Chem. 1992, 96, 4008-4014.
[6] A Laschewsky, Curr. Opin. Coll. Interface Sci. 2012, 17, 56-63.

Kommentare
Keine Kommentare gefunden!