Silicone: Grenzgänger mit außergewöhnlichen Eigenschaften
100 Jahre Makromolekulare Chemie
Silicone sind äußerst vielseitig und prägen unseren Alltag wie kaum ein anderer Werkstoff. Ob im Bad, in der Küche, im Auto oder im Flugzeug – Silicone sind überall zugange. Sie kleben und dichten, schmieren und isolieren, schützen vor Wasser und Schmutz, halten Schaum im Zaum und machen Textilien und Handtücher wunderbar glatt und flauschig. Mit Siliconen fühlt sich die Haut weich und geschmeidig an. Nasse Haare lassen sich mühelos kämmen und sind auch beim Föhnen geschützt. Und weil Silicone hautverträglich sind und sich gut sterilisieren lassen, werden sie auch in der Medizin gebraucht, beispielsweise in Wundauflagen, Beatmungsmasken oder orthopädischen Hilfsmitteln.
Vor 70 Jahren begann die Herstellung von Siliconen. Zu den ersten Produkten zählten Trennmittel für die Reifenindustrie. Inzwischen existiert eine Vielzahl von Siliconen. Die Bandbreite reicht von flüssigen Ölen, Emulsionen und Harzen bis zu gummiartigen Elastomeren. Marktstudien zufolge wurden 2018 Silicone im Wert von über 15,4 Milliarden Euro umgesetzt. Die größten Siliconverarbeiter sind heute die chemische und die Prozesshilfsmittel-Industrie. Silicone werden aber auch in der Verbrauchsgüterindustrie, in der Bauchemie, in Farben und Lacken, in der Kunststoffverarbeitung, in der Energie und Elektronik, in der Autoindustrie sowie auf dem Gesundheitssektor eingesetzt – mit steigender Tendenz.
Was ist das chemische Geheimnis dieser Alleskönner und warum sind sie so erfolgreich?
Die gemeinsame Basis: das Si-O-Si-Rückgrat
Alle Silicone haben eine Gemeinsamkeit: Sie besitzen ein Siloxangerüst. Im Kern besteht dieses Gerüst aus den chemischen Elementen Silicium und Sauerstoff. Die Abfolge von Silicium-Sauerstoff-Silicium-Einheiten, kurz –Si-O-Si–, bildet das Rückgrat aller Silicone.
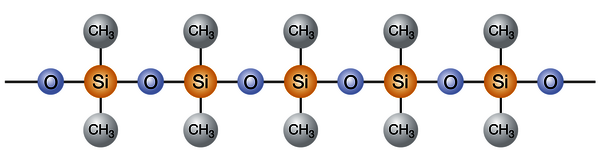
Typische Struktur eines Siliconpolymers mit Siloxangerüst. © Wacker Chemie AG
Die –Si-O-Si–Hauptkette ist für die anorganischen und polaren Eigenschaften der Silicone verantwortlich. Die beiden übrigen Valenzen des Siliciums tragen organische Reste, vorzugsweise Methylgruppen. Diese sind für den organischen und unpolaren Charakter verantwortlich. So werden die Silicone zum Grenzgänger zwischen der organischen und anorganischen Chemie.
Die hohe Bindungsenergie der Si-O-Bindung übertrifft die der C-C-Bindungen organischer Polymere deutlich und ist für die außergewöhnliche Temperatur- und UV-Beständigkeit verantwortlich (Einsatzbereich von -50 °C bis +250°C, Spezialtypen noch weit mehr).
Die große Bindungslänge der Si-O-Bindung und der flexible Bindungswinkel wirken wie ein Kugelgelenk. Die leichte Rotation um die Si-O-Bindung und damit die Beweglichkeit der Methylgruppen führt zu niedrigen intramolekularen Wechselwirkungen, niedriger Viskosität, niedrigem Glaspunkt und dem charakteristischen Dämpfungsverhalten der Polymere. Durch Wahl geeigneter Füllstoffe kann die Relaxationszeit der Ketten und damit die Dämpfung gezielt eingestellt werden.
Grenzenlose Flexibilität
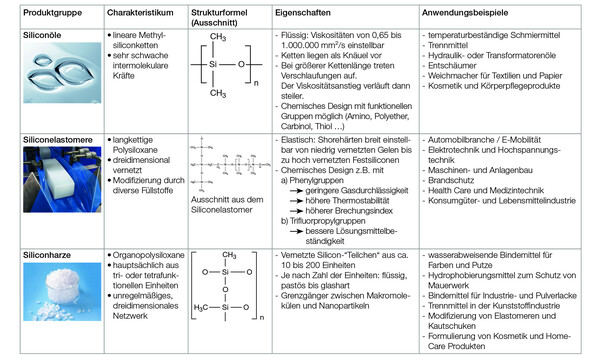
Überblick über den Zusammenhang zwischen chemischer Struktur und Eigenschaften von Siliconölen, -elastomeren und -harzen. © Wacker Chemie AG
Ein Siliciumatom hat im Siloxangerüst jeweils vier Bindungspartner. In der Siloxankette können daher bis zu drei organische Substituenten eingebaut werden. Typische Reste sind Methyl-, Vinyl-, Phenyl- oder auch funktionelle organische Gruppen. So ergibt sich eine Vielzahl von Grundbausteinen.
Daneben beeinflussen weitere Parameter die Eigenschaften eines Silicons:
- Länge der Polysiloxanketten
- Verzweigung der Hauptkette
- Grad der Vernetzung
Man unterscheidet Siliconöle, -elastomere und -harze als Hauptproduktgruppen.
Ein Ausblick: Elektroaktive Polymere

Herstellung von Laminaten aus ultradünner Siliconfolie und flexiblen Elektroden. © Wacker Chemie AG
Was für ein Potenzial in den Siliconen steckt, zeigen EAP-Anwendungen. EAP steht hierbei für „Elektroaktive Polymere“ – also Polymere, die unter elektrischer Spannung ihre Form verändern.
Hierfür werden Laminate aus ultradünnen Siliconfolien (20 µm bis 400 µm) und flexiblen Elektroden hergestellt. Liegt eine elektrische Spannung an, werden die einzelnen Elektroden alternierend positiv und negativ geladen. Dadurch wird die Siliconfolie zusammengedrückt und in der Länge gedehnt; es kommt zu einer spannungsinduzierten Bewegung. Werden die Elektroden entladen, geht die Siliconfolie in ihren Ausgangszustand zurück. Dieser Vorgang kann millionenfach in hoher Frequenz wiederholt werden.
Die EAP-Technologie kommt z.B. in Sensoren zur Erfassung von Körperbewegungen in Medizin, Sport und Lifestyle, Touch-Displays sowie in Ventilen, Pumpen, Relais zum Einsatz.
Autor: Dr. Wolfram Schindler (Wacker Chemie AG)
Redaktionelle Bearbeitung: Lisa Süssmuth, GDCh
Hinweis der Redaktion: Kommentare von Leserinnen und Lesern sind willkommen. Beiträge, die aber nur dazu dienen, auf eine komerzielle Webseite zu verweisen, werden nicht veröffentlicht.

Kommentare
Keine Kommentare gefunden!