Chlor, ein „janusköpfiges“ Element

2019 - Jahr des Periodensystems
Chlor (Cl2) ist das 17. Element des Periodensystems, es gehört neben Fluor, Brom und Iod (sowie Astat) zu den Halogeniden. Sein Atomgewicht, 35,45, resultiert aus dem Auftreten der beiden Isotope 35Cl und 37Cl im Verhältnis von etwa 3:1. Im Normalzustand ist Chlor gasförmig (Siedepunkt: -34,6°C) und mit einer Dichte von 3,2 g/l doppelt so schwer wie Luft. Chlor gehört mit 0,19% zu den häufigeren Elementen der Erdkruste (einschließlich der Ozeane). Für den menschlichen Organismus ist Chlor essentiell, z.B. als HCl in der Magensäure.
Der Eintritt von Chlor ins Reich der Stoffe stand unter dem Zeichen einiger Dispute in der Frühzeit der Chemie als Wissenschaft. Es ging um die Konkurrenz zwischen Phlogiston, einem Baustein, der – so die damalige Lehre – brennbaren Stoffen innewohnt und während der Verbrennung entweicht, und Sauerstoff, einem Bestandteil der Luft, dessen Existenz und Eigenschaften erst gegen Ende des 18. Jahrhunderts entdeckt wurden. Zu dieser Zeit verblasste auch allmählich der Glaube, dass die materielle Welt aus den Mischungen von nur vier Elementen, Feuer, Wasser Erde und Luft besteht. Damals steckte aber die Vorstellung von den chemischen Elementen – also Stoffen, die nicht aus weiteren Stoffen zusammengesetzt sind, – noch in den Kinderschuhen. Außerdem galt es nach der Entdeckung des Sauerstoffs als abgemacht, dass Säuren diesen enthalten müssen.
Carl Scheele hat Chlorgas 1774 als erster isoliert. Um 1810 konnte Humphrey Davy den Elementcharakter beweisen. Er gab dem grünlichen Gas seinen Namen entsprechend seinem Aussehen, nach dem griechischen „chloros“ – hellgrün. Scheele war der Überzeugung, dass Chlor, hergestellt aus Salzsäure bzw. Muriatic Acid (beides Bezeichnungen für die wässrige Lösung von HCl), ein dephlogistoniertes Produkt der Muriatic Acid sei. Muriatic leitet sich vom lateinischen Wort für Salzsole „muria“ ab; als „Salz“ schlechthin gilt auch heute noch NaCl. Die Lavoisier-Schule, die Sauerstoff als Element vertrat und Phlogiston als Hirngespinst verwarf, meinte, in Chlor eine Sauerstoffverbindung der Muriatic Acid zu erkennen. Beides erwies sich zwar als falsch, war aber gleichzeitig fruchtbar für den Fortgang der Chemie als Wissenschaft. Dieser Theoriestreit ist dargestellt in dem Buch „An element of controversy – The Life of Chlorine in Science, Medicine, Technologie and War“. Dort wird auch beschrieben, was Chemiker veranlasst hat, den uns geläufigen Begriff Element einzuführen. Auch bei dieser Konzeptbildung spielt Chlor eine Rolle. Aus Sicht des 21. Jahrhunderts sind die experimentellen und gedanklichen Kraftakte der Akteure, die aus der Alchemie die Naturwissenschaft Chemie entwickelten, nur noch schwer nachvollziehbar, aber – genauer betrachtet – ebenso großartig wie die kopernikanische Wende.
Chlor in der Anwendung
Ebenso spannend ist es zu sehen, wie schnell und pfiffig die damaligen Chemiker das Element Chlor wirtschaftlich nutzbar gemacht haben. Schon früh erkannte man die hohe Reaktivität von Chlor und seinen anorganischen Verbindungen, insbesondere von Salzsäure und Hypochloriten, z.B. Chlorkalk Ca(OCl)2 (im Gemisch mit CaCl2 und Ca(OH)2).
Während der Brockhaus aus dem Jahre 1837 für Chlor bereits einige Einsatzgebiete, vor allem das Bleichen von Stoffen, und einige Folgeprodukte beschreibt, kennt das Meyersche Lexikon von 1903 schon eine gewaltige Palette von Chlorprodukten aus der chemischen Industrie. Heute ist Chlor eines der wichtigsten Grundprodukte der Chemie weltweit: Allein in Deutschland werden jährlich vier Millionen Tonnen hergestellt. Elektrolysen an 18 Standorten mit einer Gesamtkapazität von 5,1 Mio t Chlor versorgen eine hochkomplexe Folgechemie. Das erzeugte Chlor wird zu einem geringen Anteil für Desinfektionszwecke direkt eingesetzt, der Löwenanteil geht über Zwischenstufen in eine riesige Produktpalette chemischer Erzeugnisse ein, die unseren Alltag bestimmen. Aus dieser gewaltigen Bedeutung entspringt auch eine besondere Verantwortung für die Chemie (s. unten).
Herstellung von Chlor
Ursprünglich gewann man Chlor durch Umsetzung von Salzsäure mit Braunstein, MnO2. Die entstehenden Mangan(II)Salze wurden mit (Luft)sauerstoff wieder zu MnO2 regeneriert. Das eigentliche Oxidationsmittel war somit Sauerstoff. Heute ist Natriumchlorid (Steinsalz, NaCl) die mit Abstand wichtigste Ausgangsbasis für die technische Erzeugung von Chlor. Steinsalz wird meist in riesigen unterirdischen Steinsalzlagerstätten, die es auch in Deutschland gibt, bergmännisch abgebaut. Von dort geht es in die Salzlöserei einer Chloralkalielektrolyseanlage, in der das Salz in Reinstwasser aufgelöst wird. Über diverse Reinigungsstufen wird eine 26 %-ige Sole in die Elektrolysezellen des Zellensaals gepumpt. Die abgereicherte Sole kehrt in die Löserei zurück, wo sie mit weiterem Salz wieder aufkonzentriert wird.
Die Herstellung von Chlor erfolgt elektrochemisch; die Reaktionen der Chloralkalielektrolyse:
Gesamt: 2 NaCl + 2 H2O → Cl2 + 2 NaOH + H2
Anodenreaktion: 2 NaCl → Cl2 + 2 Na+ + 2e-
Kathodenreaktion: 2 Na+ + 2H2O + 2e-→ 2 NaOH + H2
Neben Chlor als Wertprodukt entstehen zwei ebenso zentrale Grundchemikalien, Natronlauge (NaOH) und Wasserstoff (H2), unverzichtbare Bausteine in der Wertschöpfungskette der chemischen Industrie. Während der größte Teil des Wasserstoffs in der Chemie aus anderen Quellen stammt, ist die Chloralkalielektrolyse auch der Hauptlieferant von Natronlauge.
Die drei klassischen Verfahren der Chloralkalielektrolyse, das Amalgamverfahren, das Diaphragmaverfahren und das Membranverfahren, bedienen sich unterschiedlicher Methoden, um Sole und Chlorgas von Natronlauge und Wasserstoff sicher fernzuhalten. Aufgrund seiner hohen Energieeffizienz und guten Handhabbarkeit verdrängt das Membranverfahren derzeit die beiden älteren Verfahren. Herzstück ist eine hochselektive und gleichzeitig sehr stabile Kationenaustauschermembran. Diese hauchdünne, perfluorierte Membran, funktionalisiert mit Sulfonsäure- und Carboxylatgruppen, trennt Anodenraum und Kathodenraum, gestattet den Durchgang von (hydratisierten) Na+-Ionen, ist aber undurchlässig für Anionen (OH- oder Cl-).
In den Zellen finden bei Stromdichten von einigen tausend Ampere pro m² Elektrodenfläche und Zellspannungen von knapp 3 Volt die genannten Reaktionen statt. Aus dem Zellensaal gelangen Chlor, Natronlauge und Wasserstoff in getrennten Strängen in die jeweilige Aufarbeitung. Chlor und Wasserstoff werden getrocknet, Natronlauge auf die erforderliche Konzentration, z.B. 50%, eingestellt. In den Werken der chemischen Industrie sind alle drei Produkte über Rohrleitungen mit den Anlagen verbunden, in denen die Folgechemie stattfindet. Im Gegensatz zu Natronlauge, für die es in der Regel große Lagertanks gibt, wird Chlor aus Gründen der Sicherheit nur in kleinen Mengen gepuffert.
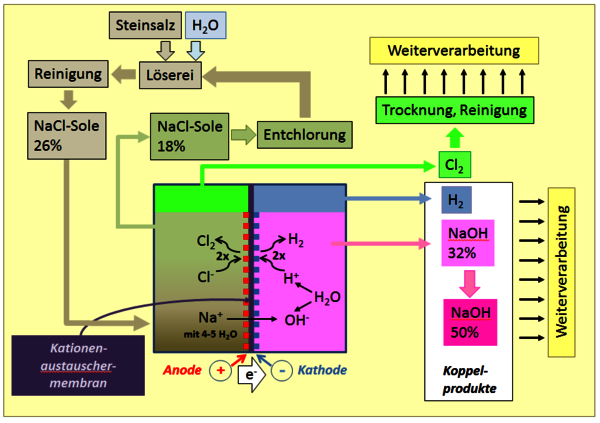

Zunehmend wird Chlor aus einigen Prozessen, bei denen HCl anfällt, durch HCl-Elektrolyse oder durch katalytische Oxidation mit Sauerstoff (Deacon-Prozess) recycelt.
Die Reaktionsgleichungen:
Elektrolyse: 2 HCl → H2 + Cl2
Deacon-Prozess: 2 HCl + ½ O2 → Cl2 + H2O
Der Deacon-Prozess nutzte ursprünglich Kupferchlorid als Katalysator. Etliche Varianten dieses Prozesses mit Edelmetallkatalysatoren werden heute großtechnisch ausgeübt.
Die Firma Bayer hat eine elegante Kombination aus Elektrolyse und Oxidation mit Sauerstoff entwickelt:
Anodenreaktion: 2 HCl → 2e- + Cl2 + 2 H+
Kathodenreaktion: 2H+ + 1/2 O2+ 2e- → H2O
Der Trick ist der Einsatz einer so genannten Sauerstoffverzehrkathode. Die Reduktion von Sauerstoffgas anstelle der Reduktion von Protonen senkt den Energiebedarf des Prozesses gegenüber dem Stand der Technik um etwa ein Drittel.
Der Chlorstammbaum
Ein ausführlicher Chlorstammbaum, der zeigt, welche Produkte aus Chlor hergestellt werden, ist unter www.worldchlorine.org/wp-content/uploads/2015/10/Chlorine-Tree-2015.pdf zu finden. Ausgehend von Chlor sind 34 Hauptäste dargestellt, die Äste wiederum verzweigen sich hundertfach, wobei in der Graphik aus Platzmangel viele Stoffe zu Produktgruppen zusammengefasst sind. Ein vereinfachter und damit anschaulicher Stammbaum ist beim Verband der chemischen Industrie, VCI und bei Eurochlor zu finden:
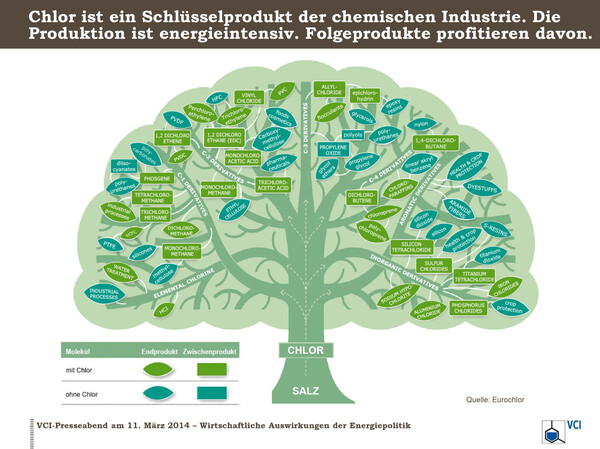
Wie zu erkennen ist, steckt Chlor in Pharmazeutika, Pflanzenschutzmitteln, Kunststoffen aller Art, funktionalisierter Cellulose, Farben, Lacken, Lösemitteln, Pigmenten oder Kosmetika. Die Bereiche, in denen diese Stoffgruppen zum Einsatz kommen, umfassen das gesamte Spektrum unseres modernen Lebens.
Das World Chlorine Council hat versucht, die riesige Anwendungsbreite in einer Art Anwendungsstammbaum darzustellen. Die wichtigsten Anwendungsgebiete von Chlor und Natronlauge:
Konsum
Kommunikation: IT-Netze, Telefon, PCs, Radio, TV
Freizeit: Skateboards, Rucksäcke, Fahrräder, Tennisschläger, Anglerbedarf, Fußbälle
Kleidung: Wasserfeste Kleidung, Brillen, Helme, schusssichere Westen, Moskitonetzte
Strom
Stromerzeugung: PV, Windturbinenblätter
Stromverbrauch: IT-Bereich, Glasfasernetze, Brennstoffzellen
Transport
Flugzeuge, Züge: Motoren, Sitze, Griffe, Sicherheitsgurte, Schläuche
Autos, Busse: Polster, Keilriemen, Stoßstangen, Dichtungsmaterialien, Armaturen
Hygiene
im Haushalt: Reinigungsmittel aller Art, Desinfektionsmittel
persönliche Hygiene: Windeln, Zahnpasta, Seifen, Mundhygiene
Wasserbehandlung
Trinkwasser: Wasserfilter, Rohre und Schläuche, Wasserbehandlung
Abwasser: Toilettenhygiene, kommunale Abwasserbehandlung
Wohnen
Gebäude: Verbundbauholz, Fenster, Fensterrahmen, Wärme- und Kabelisolierung,
Rohre, Wand- und Tapetenfarbe, Dachdeckung, Bodenbeläge
Möbel, Einrichtung: Lacke, Matratzen, Teppiche, Beleuchtung
Ernährung
Lebensmittelsicherheit: Desinfektions- und Spülmittel, Verpackungsfolien/-behälter
Lebensmittelverteilung: Transportcontainerhygiene, Kühlcontainer
Lebensmittelproduktion: Düngemittel, Insektizide, Herbizide
Medizin
Pharmazeutika: Aspirin, Penicilline, Antibiotika, Antidepressiva, Vitamine, Pilzmittel
Gesundheitsvorsorge: Prothesen, techn. Praxis- und Krankenhausbedarf, Sensoren
Quelle: (H Pütter, nach https://chlorine.americanchemistry.com/Free-Resources/Downloadable/Sustainability-Commitments-and-Actions.pdf; Seite ist aktuell nicht mehr online)
Aus dem Chlorstammbaum und seiner Anwendungsbreite lässt sich die schon angesprochene Problematik ableiten. Obwohl die Mehrheit der Chlorfolgeprodukte kein Chlor mehr enthält, gibt es eine beachtliche Zahl von Produkten mit Chlor im Molekülgerüst. Dies ist kein grundsätzliches Problem, denn chlorhaltige Produkte sind nicht per se umweltkritisch. Auch die Natur erzeugt in großen Mengen Chlororganika, und das Element Chlor gehört zu den essentiellen Elementen der Biosphäre. Aber einige dieser Stoffe haben eine hohe Stabilität in unserer Umwelt. So werden PVC-Rohre beispielsweise gerade deshalb breit eingesetzt, weil sie mechanisch einigermaßen stabil und chemisch fast unverwüstlich sind. Gerade diese Stabilität einiger Stoffe ist wegen der Persistenz in ökologischen Systemen eine Achillesferse. Chlororganika waren die ersten Chemieprodukte, bei denen großräumige und kritische Umweltauswirkungen erkannt wurden. Viele Strategien, um diese Auswirkungen frühzeitig zu erkennen und zu vermeiden, wurden daraufhin entwickelt. Chlor steht damit als Paradigma für den Umgang mit den Produkten der technischen Zivilisation schlechthin.
Chlor und Verantwortung
In seinem Buch „Das wilde Leben der Elemente – Eine Kulturgeschichte der Chemie“ präsentiert Hugh Aldersey-Williams Chlor als „ein janusköpfiges Element“. Mit dessen Einsatz im ersten Weltkrieg als Kampfgas belegt er die Gefährlichkeit von Chlor und seinen Verbindungen. Das andere Gesicht von Chlor: Die Behandlung von Trinkwasser mit Chlor hat unzählige Menschen vor Infektionskrankheiten oder gar vor dem Tod bewahrt. Außerdem zeigt der Chlorstammbaum eindrucksvoll, wie unverzichtbar die Chemie des Chlors für jede moderne Gesellschaft ist.
Chlor hat in der Diskussion um die Verantwortung der Chemie für ihre Dienstleistung und Produkte unter dem Stichwort „Chlorchemie“ eine spezielle Rolle gespielt, die auch das Selbstverständnis der Chemie als reflektierte Praxis vorangetrieben hat. Zwei Beispiele:.
1) Oft ist die Gefahr, die von Chlorverbindungen ausgeht, nicht offensichtlich. So wurde DDT, Dichlor-Diphenyl-Trichlorethan, zur Schädlingsbekämpfung im großen Stil eingesetzt, da sein Einsatz im Vergleich zu vielen anderen Insektiziden für den Menschen wegen seiner geringen Toxizität unkritisch erschien. Für diese Anwendung hat der Schweizer Chemiker Paul Hermann Müller 1948 den Nobelpreis in Medizin erhalten. DDT war ein effektives Mittel im Kampf gegen die Malaria und hat einer gewaltigen Anzahl von Menschen das Leben gerettet oder sie vor Gesundheitsschäden bewahrt. DDT und anderer chlorierte Kohlenwasserstoffe sind jedoch auch sehr langlebig; so können sie sich in der Nahrungskette anreichern und dort zu Problemen führen. Diese Kehrseite bemerkte man erst mit Verzögerung. Das berühmte Buch von Rachel Carson, „Silent Spring“, aus dem Jahre 1962, ein Meilenstein in der Umweltliteratur, thematisierte dies erstmals für ein breites Publikum. Auch wenn Rachel Carson zunächst auf Wiederstand stieß, begannen in der Chemie zwei Entwicklungen: Zum einen wurden besser abbaubare Insektizide entwickelt. Zum anderen verfeinerte die Analytik ihr Instrumentarium derart, dass Umweltanalytik heute in der Lage ist, jede Fährte eines Stoffes, empfindlich wie ein Spürhund, aufzunehmen. Diese Disziplin hat sich zu einem eigenständigen Wissenschaftszweig entwickelt. Die 1990 gegründete GDCh-Fachgruppe „Umweltchemie und Ökotoxikologie“ belegt dies. Die Entstehung dieses neuen Wissenschaftszweiges löste gleichzeitig einen Denkprozess aus: Es ging – und geht – um die Fragen: Wo endet unsere Verantwortung? Haben wir Antennen für Probleme am Horizont? Nehmen wir Kritik aus der Gesellschaft ernst und – umgekehrt - werden unsere Bemühungen ernst genommen? Dieser Prozess verlief nicht geradlinig und wurde oft auch durch heftige Kritik von außen angestoßen, aber er hat die gesellschaftliche Rolle der Chemie neu definiert.
2) Auch die Fluorchlorkohlenwasserstoffe, FCKW, galten wegen ihrer Reaktionsträgheit und Ungiftigkeit als besonders sichere Treib- und Kühlmittel. Ihre ozonschädigende Wirkung wurde erst offenbar, als sich schon gewaltige Mengen in der Atmosphäre angesammelt hatten. Immerhin verfügte die Umweltchemie nun über das nötige Instrumentarium, um Gesellschaft und Politik von den Gefahren zügig zu überzeugen. 1987 fand in Kanada eine internationale Konferenz zum Schutze der Ozonschicht statt. Die dort im „Montreal Protokoll“ vereinbarten Gegenmaßnahmen gelten als eines der wenigen Beispiele, in denen wissenschaftliche Erkenntnisse rasch und erfolgreich zu einer internationalen Umweltkooperation geführt haben. Paul Crutzen, Mario J. Molina und Frank S. Rowland erhielten für ihre Erforschung des Ozonlochs im Jahre 1995 den Chemienobelpreis.
Trotz seiner Nützlichkeit steht Chlor wie kaum ein anderes Element für die Zweischneidigkeit menschlicher Technik. Gerade die gewaltige Vielfalt seiner Folgeprodukte zwingt uns Chemiker als Naturwissenschaftler, uns intensiv mit den Folgen unseres Handelns zu befassen. So gilt es, den Spürsinn für versteckte Neben- bzw. Folgeeffekte zu trainieren und wachzuhalten. Zugleich muss die Fähigkeit, Alternativen zu „klassischen“ Pfaden zu entwickeln, fit gehalten werden.
Nicht nur Chlorabkömmlinge, sondern auch etliche andere Stoffgruppen standen oder stehen in der öffentlichen Kritik. Dies führte dazu, dass Chemiker weltweit unter dem Stichwort „Green and Sustainable Chemistry“ eine intensive Bestandsaufnahme ihres Tuns vornahmen und diese ständig weiter führen. Der Umgang mit Chlor und seinen Produkten war ein wichtiger Auslöser dieser Entwicklung.

Dr. Hermann Pütter
Bis 2005 Wissenschaftlicher Direktor bei BASF, bis 2014 Koordinator Chemie und Energie der GDCh
Bildnachweis Titelbild: W. Oelen, Chlorine ampoule, CC BY-SA 3.0

Kommentare
Keine Kommentare gefunden!