Eisen – Universalmetall der modernen Menschheit

2019 – Jahr des Periodensystems
Omnipräsent und doch in seiner Vielfalt häufig unterschätzt – als besonders beständiges chemisches Element kommt Eisen im gesamten Universum vor. Auf unserer Erde finden wir Eisen in verschiedensten Erscheinungsformen, in unterschiedlichsten Umgebungen und mit einer Vielzahl komplexer Aufgaben für unser Leben.
Eisen bildet nicht nur den Hauptbestandteil des Erdkerns, sondern ist (nach Sauerstoff, Silicium und Aluminium) auch das vierthäufigste Element der Erdkruste. Dort findet man es zumeist in Form seiner Oxide in Erzen unterschiedlicher Zusammensetzung wie Fe2O3 oder Fe3O4.[1] Eisenerze werden seit langer Zeit von den Menschen abgebaut und zählen zu den ältesten bekannten Rohstoffen. Die Gewinnung von Eisen aus dem abgebauten Erz, seine Verarbeitung und Nutzung spielten schon in der frühen Menschheitsgeschichte eine zentrale Rolle zur Herstellung von Waffen, Werkzeugen, landwirtschaftlichen Geräten und anderen Kulturgegenständen. Die ersten bekannten Eisengegenstände sind 6000 Jahre alte Perlen aus dem alten Ägypten. Viele Legenden rankten sich im Altertum um dieses Metall; so erfanden laut Plinius dem Älteren bereits die Zyklopen das Schmieden des Eisens und die Sumerer bezeichneten es als „Metall des Himmels“. Heute wissen wir, dass jedes Lebewesen dieser Erde auf Eisen als essentielles Spurenelement angewiesen ist – im Körper eines erwachsenen Menschen finden sich insgesamt etwa 4.5 g Eisen.[2] Die große Vielfalt der Chemie dieses Metalls liegt zum einen in der guten Zugänglichkeit der beiden Oxidationsstufen +II und +III sowie der breiten Spanne möglicher Oxidationsstufen von -II bis +VI, und zum anderen in seiner Lewis-Acidität und seiner flexiblen Koordinationsumgebung begründet.
Von der Eisenzeit bis heute
1. Von Werkstoffen über Farben bis zu Batteriematerialien
Seit der Eisenzeit vor über 3000 Jahren hat sich die Anwendung dieses Metalls vielfach gewandelt und weiterentwickelt – dennoch ist Eisen auch für den Menschen der Moderne ein Rohstoff von immenser Bedeutung. Der durch Hochofenprozess und Thermit-Verfahren gewonnene Stahl findet sich heute allerorts in der Konstruktion von Generatoren, Brücken und Bauwerken. Eisenoxid-Pigmente, meist gelb – rot – dunkelbraun wurden bereits in der jungpaläolithischen Höhlenmalerei verwendet. Da sie lichtecht sowie wetter- und chemikalienbeständig sind, werden Eisenoxid-Pigmente auch heute in großer Menge für Farb- und Lackanwendungen genutzt, so beispielsweise in Dach- und Pflastersteinen, Kunststoffen und Laminaten.[3]
Die Synthese und Isolierung von Berliner Blau, Fe4[Fe(CN)6]3, durch den Farbenhersteller Diesbach um 1705 gilt gemeinhin als Startpunkt der präparativen Chemie von Metallkomplexen.. Aufgrund ihrer extremen Farbstärke und hohen Farbechtheit finden Eisen-Blaupigmente weiterhin breite Anwendung, u.a. als Druckfarben und chemische Beschichtungen. In der Forschung erleben Verbindungen des Berliner Blau-Typs AxMy[M‘(CN)6]z (A = einwertige Metallkationen wie Na+ oder K+; M und M’ = drei- bzw. zweiwertige Übergangsmetallionen; Abb. 1) nun seit einigen Jahren eine wahre Renaissance, insbesondere in nanopartikulärer Form sowie in Form molekularer Analoga.[4] So werden sie wegen der schnellen und reversiblen Insertion/Extrusion von Na+ und K+ in/aus der Gerüststruktur u.a. als preisgünstige Kathodenmaterialien in Alkalimetallionenbatterien erprobt.[5]
Die intensive Farbigkeit der Eisen-Blaupigmente resultiert aus Elektronenübergängen zwischen den Metallionen M und M‘ (Metall-Metall Charge-Transfer). Bei geeigneter Wahl der Metallionen (z.B. M = Co, M‘ = Fe) gehen diese optischen Charge-Transfer-Anregungen mit dramatischen Änderungen der magnetischen Signaturen des Materials einher, wodurch solche Verbindungen vielversprechende Eigenschaften als photomagnetische Nanoschalter aufweisen.[6] Aufgrund des photothermischen Effekts bei langwelliger Charge-Transfer-Anregung werden Berliner Blau-Nanopartikel zudem in der Krebstherapie getestet, während dotierte Varianten als Kontrastmittel für die Magnetresonanztomographie eingesetzt werden.[4] Mögliche biomedizinische Anwendungen profitieren davon, dass Berliner Blau-Nanopartikel in wässriger Lösung über einen weiten pH-Bereich von 2 bis 7.5 stabil sind und Berliner Blau von der US-amerikanischen Food and Drug Administration (FDA) bereits als Antidot bei Caesium- oder Thallium-Vergiftung in der Humanmedizin zugelassen ist. Das Berliner Blau ist also ein schönes Bespiel dafür, wie altbekannte Verbindungen des Eisens durch neue Untersuchungsmethoden und moderne Fragestellungen zum Dauerbrenner in der Forschung werden.
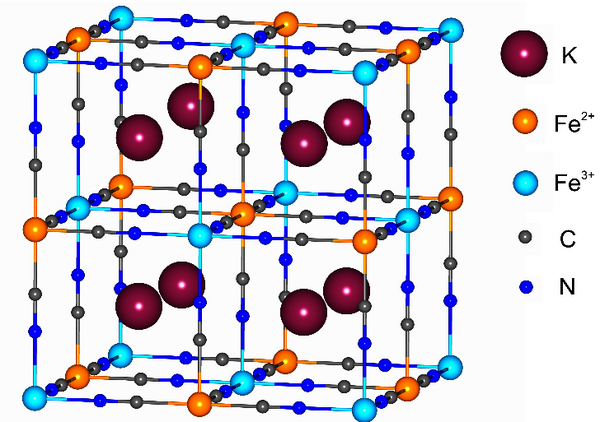
Abb. 1: Netzwerkstruktur des Berliner Blau-Typs KFeIII[FeII(CN)6] (Sebastian Dechert, Universität Göttingen)
2. Medizinische Chemie des Eisens
Schon in der Antike erkannten die Menschen, dass Eisen nicht nur als Werkstoff sondern auch als medizinscher Wirkstoff vielfältig eingesetzt werden kann. So findet sich in der Bibliotheke des Apollodor folgende Begebenheit: Iphiklos, Prinz von Thessalien und einer der Argonauten, litt unter Impotenz. Der Heiler und Seher Melampus verabreichte ihm einen Trunk aus Wein und dem Rost eines alten Eisenmessers, und bereits nach zehn Tagen war der Prinz von seinem Leiden erlöst und somit auch die Thronfolge gesichert.[7] Noch bis ins 17. Jahrhundert wurde solch ein Trunk als „Medizin“ verabreicht.
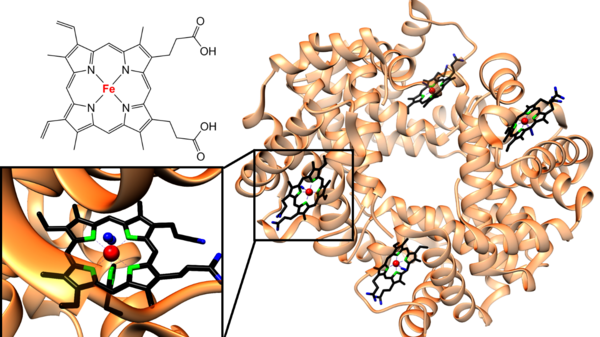
Heute ist die medizinische Bedeutung von Eisen eingehend erforscht und weit besser verstanden. Eisen ist ein essentielles Spurenelement und an fast allen wichtigen Lebensprozessen beteiligt.[2] Ein großer Teil des Eisens im menschlichen Körper findet sich im roten Blutfarbstoff, dem Hämoglobin – als Häm bezeichnet man die in der Biologie weit verbreiteten Komplexverbindungen des Eisens mit Porphyrinliganden. Hämoglobin besteht aus vier Protein-Untereinheiten, welche jeweils eine Hämgruppierung enthalten, die auch für die rote Farbe des Blutes verantwortlich ist. Jede der vier Hämeinheiten kann durch Bindung an das zentrale Eisenatom ein Sauerstoffmolekül aufnehmen, wobei die Aufnahme von vier Sauerstoffmolekülen pro Tetramer durch allosterische Effekte begünstigt wird. Im Gewebe kann der Sauerstoff am Zielort wieder freigesetzt werden und so die Versorgung des gesamten Organismus mit Sauerstoff sichergestellt werden.[8]
Gespeichert wird Eisen im menschlichen Organismus in Ferritin, einem Speicherprotein mit einem anorganischen Kern mit bis zu 4000 Eisenatomen pro Proteineinheit. Eisenmangel kann zu vielfältigen Symptomen führen und betrifft das Nervensystem, Herz und Blutkreislauf und auch Haut und Schleimhäute. Daher ist die Einnahme von Eisen in konzentrierter Form über Nahrungsergänzungsmittel populär. Allerdings ist auch ein Eisenüberschuss für den Menschen gesundheitsschädlich, da Eisen vor allem in der Oxidationsstufe +II an der Bildung freier Radikale beteiligt ist, welche die Zellen angreifen und so Organschäden verursachen können. Bei einer sogenannten Siderose reichert sich Eisen in der Leber an, was zur Leberzirrhose führen kann. Da der Körper keinen eigenen Mechanismus zur aktiven Eisenausscheidung besitzt, wird diese Eisenspeicherkrankheit mit Aderlässen behandelt.
3. Mehr als nur Sauerstofftransport: Eisen als Schlüsselelement des Lebens
In den Aktivzentren ihrer Biokatalysatoren, den Enzymen, nutzt die Natur das Übergangsmetall Eisen zur Vermittlung einer Vielzahl biochemischer Prozesse. Eisenhaltige Enzyme finden sich in allen Formen des Lebens und sind maßgeblich an essentiellen Prozessen wie der Photosynthese und in der Atmungskette beteiligt. Diesen mannigfaltigen Einsatz verdankt das Eisen unter anderem seiner hohen Bioverfügbarkeit als gut lösliches Fe2+ in der reduzierenden, sauerstofffreien Atmosphäre der frühen Erdgeschichte. Einer vielzitierten Theorie zufolge soll auch das Leben auf unserem Planeten an der Oberfläche von Eisen-Schwefel-Mineralen über einen chemoautotrophen Stoffwechsel entstanden sein.[9] Der Frühzeit der Evolution entstammen also wohl die vielfältigen Fe/S-Kofaktoren, die sich heute ubiquitär – meist als Elektronentransfereinheiten – in allen Lebensformen finden.[10] So erfolgt beispielsweis die biologische Fixierung von Stickstoff zu Ammoniak an einem Fe/S-Kofaktor, der neben einem Molybdänatom sogar 7 Eisenatome enthält.[11]
Das wohl prominenteste Beispiel für Eisenenzyme sind die – auch biotechnologisch genutzten – Cytochrome P450, die im menschlichen Organismus insbesondere in der Leber vorkommen. Cytochrome P450 sind Häm-haltige Monoxygenasen die u.a. die Hydroxylierung von C-H-Gruppen unter Nutzung von O2 katalysieren. Dabei kommt es zur Bildung einer hochvalenten Fe(IV)=O-Spezies als hochreaktivem Intermediat, der sog. „biologischen Brennfackel", welche ein O-Atom in die C-H Bindung einschiebt. Die Stabilisierung dieser hohen Oxidationsstufe und die Ausbildung einer stark nucleophilen und basischen Sauerstoffspezies werden im Enzym durch die besondere Koordinationsumgebung des elektronengebenden Porphyrinrings und durch den axialen Thiolat-Steuerliganden ermöglicht.[12]
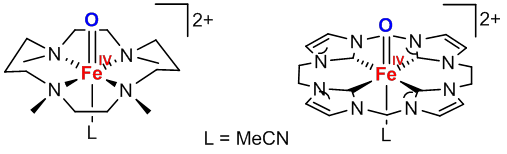
Aktuelle Forschung zur Chemie des Eisens bewegt sich heute oft an der Schnittstelle von Chemie und Biologie und beleuchtet die Rolle einzelner Metallionen für die Funktionalität unterschiedlicher Enzyme. Die bioanorganische Chemie beschäftigt sich hierzu auch mit der Synthese und Charakterisierung von biomimetischen Modellverbindungen, die das aktive Zentrum der Enzyme ohne die Umgebung des Poteinrückgrates gezielt nachbilden. Dazu sind oft ein ausgeklügeltes Liganden-Design und besondere Arbeitstechniken nötig. Derartige Modelle konnten vielfach zum Verständnis der Struktur und Funktion ihrer natürlichen Vorbilder beitragen. So konnte die Gruppe um Lawrence Que 2003 ein Modellsystem mit einer hochvalenten Fe(IV)=O-Einheit kristallographisch beschreiben.[13] Dieses Modellsystem lieferte einen entscheidenden Beweis für die tatsächliche Zugänglichkeit der Eisen-Oxo-Spezies, die zuvor als Schlüsselintermediat in der Reaktivität von Häm- und Nicht-Häm-Eisenproteinen postuliert worden war. Kürzlich konnte die hochreaktive Fe(IV)=O-Einheit auch in einem Tetracarben-Makrozyklus stabilisiert werden, was zeigt, wie sich Konzepte der bioanorganischen und metallorganische Chemie zusammenführen lassen.[14]
4. Eisen in der technischen Katalyse: Umweltverträglich und hocheffizient
Längst sind viele Prozesse der modernen chemischen Industrie ohne den Einsatz eisenhaltiger Katalysatoren undenkbar geworden.[15] So wird im Haber-Bosch-Prozess Magnetit (Fe3O4) gemeinsam mit oxidischen Promotoren als Katalysator eingesetzt, um Ammoniak aus Stickstoff und Wasserstoff zu synthetisieren (S. Beitrag „Stickstoff“ auf Seite XXX).. Auch in der Fischer-Tropsch-Synthese kommen Katalysatoren auf Basis von Eisen zum Einsatz. In dieser Reaktion wird Kohlenmonoxid als C1-Baustein zu verschiedenen Alkanen, Alkenen und Alkoholen umgesetzt, welche als Kraftstoffe oder Grundstoffe der chemischen Industrie Anwendung finden. Hämatit-Nanopartikel (Fe2O3) werden zudem als vielversprechender Katalysatoren für die Wasseroxidation diskutiert.[16]
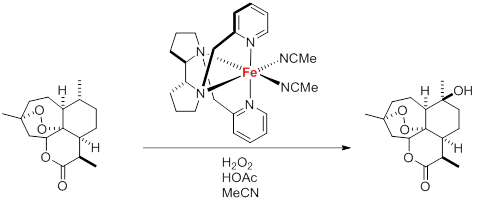
Im Zentrum aktueller Forschung steht derzeit besonders die Entwicklung von eisenbasierten Homogenkatalysatoren, die chemische Reaktionen bei milden Reaktionsbedingungen mit hoher Selektivität vermitteln.[17] Dies hängt zum einen mit der hohen Verfügbarkeit von Eisen und dem damit einhergehenden geringen Preis zusammen. Zum anderen wird angenommen, dass eisenhaltige Katalysatoren deutlich weniger toxisch sind als die entsprechenden Edelmetallanaloga und somit eine geringere Belastung für Mensch und Umwelt darstellen. Homogene Katalysatoren mit ausgeklügelten asymmetrischen Liganden ermöglichen beispielsweise bereits heute die hochselektive Oxygenierung von aliphatischen C-H-Bindungen unter milden Reaktionsbedingungen (siehe Abb. 4).[18] In den letzten Jahren hat die Zahl bekannter Umsetzungen, die durch Eisenkomplexe katalysiert werden, rasant zugenommen. Langfristig können diese nachhaltigen Varianten die klassischen Edelmetalle in der homogenen Katalyse zumindest teilweise ablösen und damit eine moderne Eisenzeit einläuten.[19]
Quellen
E. Riedel, C. Janiak, T. M. Klapötke, H. J. Meyer, Moderne Anorganische Chemie, 2. Auflage, 2007, de Gruyter, Berlin.
B. Halliwell, J. M. C. Gutteridge, Mol. Asp. Med. 1985, 8, 89-193.
G. Buxbaum, G. Pfaff; Industrial Inorganic Pigments, 3. Auflage, Wiley-VCH, Weinheim, 2005;
J. Long, Y. Guari, C. Guérin, J. Larionova, Dalton Trans. 2016, 45, 17581 - 17587.
A. Eftekhari, Z. Jian, X. Ji, ACS Appl. Mater. Interfaces 2016, DOI: 10.1021/acsami.6b07989.
D. Aguila, Y. Prado, E. S. Koumousi, C. Mathoniere, R. Clerac, Chem. Soc. Rev. 2016, 45, 203-224.
Heinrich Wilhelm Stoll: Iphiklos 1. In: Wilhelm Heinrich Roscher (Hrsg.): Ausführliches Lexikon der griechischen und römischen Mythologie. Band 2,1, Leipzig 1894, 306–308. (online abrufbar über http://www.archive.org)
W.A. Eaton et al., Nature Struct. Biol. 1999, 6, 351.
G. Wächtershäuser, Proc. Natl. Acad. Sci USA 1990, 87, 200-204.
H. Beinert, R. H. Holm, E. Münck, Science 1997, 277, 653-659.
O. Einsle, J. Biol. Inorg. Chem. 2014, 19, 737-745.
C. M. Krest, E. L. Onderko, T. H. Yosca, J. C. Callxto, R. F. Karp, J. Llavada, J. Rittle, M. T. Green, J. Biol. Chem. 2013, 288, 17074-17081.
J.-U. Rohde, J.-H. In, M. H. Lim, W. W. Brennessel, M. R. Bukowski, A. Stubna, E. Münck, W. Nam, L. Que Jr., Science 2003, 299, 1037-1039.
(a) S. Meyer, I. Klawitter, S. Demeshko, E. Bill, F. Meyer, Angew. Chem. 2013, 125, 935-939; Angew. Chem. Int. Ed. 2013, 52, 901-905; (b) C. Kupper, B. Mondal, J. Serrano-Plana, I. Klawitter, F. Neese, M. Costas, S. Ye, F. Meyer, J. Am. Chem. Soc. 2017, 1
C. H. Bartolomew, R. J. Farranto Fundamentals of Industrial Catalytic Processes, Wiley AIChE, 2nd Ed. 2005.
(a) M. J. Katz, S. C. Rih, N. C. Jeong, A. B. F. Martinson, O. K. Farha, J. T. Hupp, Coord. Chem. Rev. 2012, 256, 2521-2529; (b) O. Zandi, T. W. Hamann, Phys. Chem. Chem. Phys. 2015, 17, 22485--22503
(a) S. Enthaler, K. Junge, M. Beller, Angew. Chem. Int. Ed. 2008, 47, 3317-3321; (b) A. Fürstner, ACS Central Science 2016, 2, 778-789.
P. E. Gormsky, M. C. White, J. Am. Chem. Soc. 2013, 135, 14052-14055.
C. Bolm, Nature Chem. 2009, 1, 420.

Prof. Dr. Franc Meyer
Institut für Anorganische Chemie, Georg-August-Universität Göttingen

Dr. Marie Bergner
Department of Chemistry, Imperial College London
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Bildnachweis Titelbild: Pyrit (Eisen(II)Sulfid
JJ Harrison (https://www.jjharrison.com.au/), Pyrite from Ampliación a Victoria Mine, Navajún, La Rioja, Spain 2, CC BY-SA 3.0

Kommentare
Keine Kommentare gefunden!