Palladium – der Star unter den Katalysatoren
2019 – Jahr des Periodensystems
Die Entdeckung
Die Entdeckung des Elements Palladium fällt mit dem Jahr 1802 in den Beginn einer Phase von 1800 bis 1830, in der 22 neue Elemente in das Periodensystem „gefüllt“ werden konnten. William Hyde Wollaston entdeckte das Metall aus der sogenannten 4d-Übergangsmetall-Reihe in Platin-Erzen aus Südamerika (Abb. 1, links). Diese Erze, die von F. De Ulloa 1736 in Kolumbien entdeckt wurden und in Mengen von bis zu 10% neben dem Hauptbestandteil Platin das vergesellschaftete Palladium und in weiteren kleinen Mengen auch die weiteren Elemente der sogenannten „Platingruppe“, Rh, Ir, und Os enthalten, wurden von Wollaston im Grunde erstmals korrekt chemisch analysiert.[1,2] Stark verbesserte chemische Trenn- und Analysenmethoden ermöglichten zu Beginn des 19. Jahrhunderts das Auffinden von einzelnen Elementen in einem Verbund vergesellschafteter Elemente oder als Spuren in Erzen mit einer Hauptkomponente. Ihre Krönung erfuhr diese bewundernswerte Chemie mit der Entdeckung der Selten-Erd-Elemente nur wenig später. Wollaston benannte das neue Element nach dem 1802 entdeckten Asteroiden Pallas (Abb. 1, Mitte) und fügt sich damit in die für uns alchimistisch anmutende Tradition ein, chemische Elemente einem Himmelsgestirn (Sonne, Planeten und Monde) beizuordnen. Der Name Pallas geht auf niemand geringeren als auf Pallas Athene zurück, Tochter des Zeus und Hüterin der Wissenschaft (Abb. 1, rechts).

Abb. 1.a (links): Metallisches Palladium (Materialscientist, Palladium 1-noReflection, CC BY-SA 3.0)
Abb. 1b (Mitte): Sein „Namensgeber“, der Asteroid Pallas (Aufnahme des Hubble-Teleskops 2007 [3])
Abb. 1.c (rechts): Pallas Athene in einem Bildnis von Paris Bordone (1500-1571) zusammen mit Hephaistos, dem mythologischen Patron der Ingenieure (Paris Bordone, Athena Scorning the Advances of Hephaestus, Wikimedia Commons, als gemeinfrei gekennzeichnet
Das Katalyse-Element
Pallas ist einer der größten Asteroiden in unserem Sonnensystem und beherbergte anscheinend in den 1930er und 40er Jahren üble Raumpiraten, was in zwei bedeutenden Comic Strips (Buck Rodgers und Captain Future) festgehalten wurde. Die Chemie des Palladiums war bis zu jenen Zeiten weit weniger spannend. Nachdem im 19. und bis zur Mitte des 20. Jahrhunderts die grundlegende Chemie des Palladiums erforscht war, erhielt das Element erst in der zweiten Hälfte des 20. Jahrhunderts seine Bedeutung als Katalysator in der organischen Chemie. 1946 noch musste der heute in Hydrierungen und diversen C-C-Kopplungen unersetzbare Pd/C-Katalysator noch selbst hergestellt werden.[4] Aber spätestens mit der Entdeckung der homogenen Pd-katalysierten Kreuz-Kopplungen durch R. Heck, E. Negishi, A. Suzuki, M. Kumada, N. Miyaura, J. K. Stille u.a. boomte der Einsatz von Palladium in der Chemie (Abb. 2). Die ersten drei genannten erhielten 2010 dafür den Chemie-Nobelpreis.[5] Ähnlich spektakulär und erfolgreich verlief die Entwicklung im Bereich der Verwendung von Pd-Nanopartikel in der heterogenen Katalyse.[6]

Palladium ist so effektiv bei manchen dieser homogenen Kreuzkopplung-Reaktionen, dass schon Spuren von Palladium im eingesetzten Katalysatormaterial (hier, ein Eisen(III)-Komplex, siehe Vergesellschaftung von Elementen) für ansprechende Ausbeuten ausreichend sein können.[7] Bei der derzeit sehr angesagten Suche nach billigen 3d-Elementen als Ersatz für das recht teure Palladium oder gar dem angestrebten Verzicht auf Übergangsmetalle bei homogenen Kreuzkopplungskatalysen ist bei entsprechenden Erfolgsmeldungen also Vorsicht angebracht bezüglich des berichteten und des „wahren“ Katalysators.
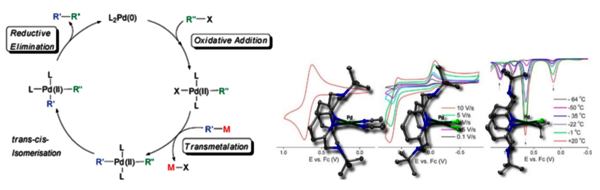
Mechanistisch gesehen überwiegen bei der Beschreibung dieser Katalysen die lehrbuchbekannten Oxidationsstufen 0, +II und +IV, sowie die Oxidative Addition, die Transmetallierung und die Reduktive Eliminierung (Abb. 3, links). Neuere Untersuchungen zeigen aber ein vielfältigeres Bild, viele weitere Reaktionstypen wurden gefunden und die scheinbar exotischen Oxidationsstufen +I und +III gewinnen an Bedeutung (Abb. 3, rechts).[8-10]
Das berühmte Palladium-H-System
Der Asteroid Pallas hat eine sehr exzentrische Bahn, was eine gute Beobachtung bisher verhindert hat (man beachte die recht schlecht aufgelöste Hubble-Aufnahme in Abb. 1, Mitte). Ebenso exzentrisch mutete lange Zeit die besondere Wechselwirkung von elementarem Palladium und Wasserstoff an, die es Pd erlaubt, große Mengen an Diwasserstoff aufzunehmen und reversibel wieder abzugeben. Heute ist klar, dass Pd den Wasserstoff unter Mischkristallverfestigung in sein Kristallgitter einlagert, es sich dabei also eher um eine Pd/H-Legierung mit maximalem H-Gehalt entsprechend PdH0.75 als um ein Hydrid handelt.[11] Sehr viel wichtiger dabei sind aber unzählige Anwendungen dieses Phänomens zur Aktivierung, Trennung und Speicherung von H2.[12] Das Pd-H2- bzw. Pd-D2/D2O-System steht aber auch für ein schwieriges Kapitel der jüngeren Wissenschaftsgeschichte, die sogenannte kalte Fusion und deren Postulierung 1989 durch S. Pons und M. Fleischmann. Den von ihnen entdeckten Effekt einer Überschuss-Wärme bei der Elektrolyse von schwerem Wasser an einer Palladium-Kathode erklärten die beiden mit kernchemischen Prozessen, eben einer Fusion. Die beiden witterten eine Sensation und veröffentlichten ihre Vermutung, konnten aber, wie später viele andere Gruppen auch, keine überzeugende experimentelle Evidenz liefern. Das United States Department of Energy (DOE) kam 1989 und 2003 nochmalig zu dem Schluss, dass es sich hierbei um pathologische Wissenschaft (im Sinne von I. Langmuir) handelt, ein Urteil, das in der Wissenschaftswelt überwiegend geteilt wird.
Hauptverwendung von Palladium
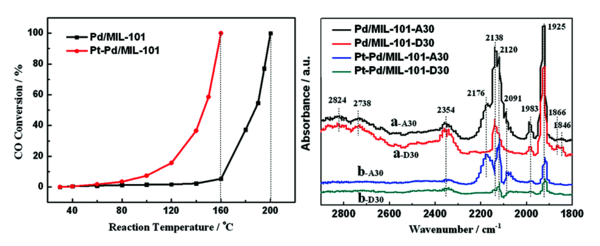
Wie bei den meisten Elementen stehen für ChemikerInnen natürlich die Chemie, die Katalyse und die phantastischen Materialen im Vordergrund, die dieses Element ermöglicht, die Hauptverwendung ist jedoch meist schnöder technischer Art. Das ist beim Palladium nur teilweise so. Hauptabnehmer der heute im Wesentlichen in Südafrika und Russland geförderten bzw. aus der Cu-Raffination (Anoden-Schlamm) stammenden Pd-Mengen sind die Autoabgaskatalysatoren unserer PKWs (ca. 65%). Die Chemie, die hinter der heterogen-katalytischen Konversion von CO, NOx, O2 und Kohlenwasserstoffen zu CO2, N2 und H2O steht, ist detailreich und weiterhin Gegenstand spannender Untersuchungen wie etwa der Anwendung von sogenannten metalorganic frameworks (MOFs) für die Pd-katalysiserte CO-Oxidation (Abb. 4).[12]
W. A. Lampadius, Die neuern Fortschritte im Gebiete der gesammten Hüttenkunde, Engelhardt, Freiberg 1839, S. 104 f.
L. Gmelin, Handbuch de Chemie, 3. Band, Winter, Heidelberg 1844, S. 771 f.
B. E. Schmidt, P. C. Thomas, J. M. Bauer, J.-Y. Li, L. A. McFadden, J. M. Parker, A. S. Rivkin, C. T. Russell, S. A. Stern, Lunar Planet. Sci. XXXIX, 2008, 1391, 2502.
R. Ozinga, Organic Synthesis 1946, 26, 77‒82
(a) C. C. C. Johansson Seechurn, A. Deangelis, T. J. Colacot, in T. J. Colacot (ed.), New Trends in Cross-Coupling: Theory and Applications, RSC Catalysis Series No. 21, Royal Society of Chemistry, Cambridge UK 2015, Kapitel 1; (b) T. J. Colacot, Plat. Me
J. Cookson, Plat. Met. Rev. 2012, 56, 83‒98.
S. Handa, Y. Wang, F. Gallow, B. H. Lipshutz, Science 2015, 349, 1087‒1091.
C. E. I. Knappke, A. Jacobi von Wangelin, Chem. Soc. Rev. 2011, 40, 4948-4962.
Q. Liu, X. Dong, J. Li, J. Xiao, Y. Dong, H. Liu, ACS Catal. 2015, 5, 6111‒6137.
J. R. Khusnutdinova, N. P. Rath, L. M. Mirica, Inorg. Chem. 2014, 53, 13112‒13129.
(a) S. Li, Y.-Z. Chen, Y.-K. Cao, F. Liu, Acta Metall. Sin. (Engl. Lett.) 2016, 29, 120‒128; (b) S. K. Konda, A. Chen, Mater. Today 2016, 19, 100‒108.
Y. Zhou, Z. Wang, C. Liu, Catal. Sci. Technol. 2015, 5, 69‒81.

Prof. Dr. Axel Klein
Department für Chemie, Institut für Anorganische Chemie, Universität zu Köln
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.


Kommentare
Keine Kommentare gefunden!