Rhodium – aus keinem Autokatalysator wegzudenken

Rhodium steht mit der Ordnungszahl 45 in der 9. Gruppe des Periodensystems. Es gehört zur 5. Periode und damit zur zweiten Übergangsmetallreihe. Zusammen mit den Elementen Ruthenium, Osmium, Iridium, Palladium und Platin bildet es die Gruppe der Platinmetalle. Rhodium ist ein Reinelement, das heißt es kommt auf der Erde nur in Form seines stabilen Isotops 103Rh vor. Der Name Rhodium leitet sich aus dem griechischen rhodeos für rosenrot ab. Die Wahl dieses Namens geht auf die tiefrote Farbe der Verbindung RhCl3 • 3H2O zurück.
Vorkommen, Entdeckung und erste Anwendungen
Das Element Rhodium gehört zusammen mit Rhenium, Iridium und Ruthenium zu den seltensten nicht-radioaktiven Metallen auf der Erde (ca. 0.001 mg/kg in der Erdkruste). Es kommt sowohl gediegen als auch gebunden in einigen wenigen Verbindungen vor. In der Regel wird es vergesellschaftet mit den anderen Metallen der Platingruppe angetroffen. Als besonders reich an Rhodium gelten einige Nickelkupfersulfide aus Lagerstätten in Südafrika und Kanada. Gewonnen wird Rhodium aus dem sogenannten „Rohplatin“, das je nach Art des Vorkommens (gediegen oder gebunden) entweder in Folge von Waschprozessen oder als Rückstand bei der Erzaufbereitung anfällt. Durch Oxidationsprozesse sowie unter Ausnutzung von Löslichkeitseigenschaften können die Platinmetalle voneinander getrennt werden, wodurch die reinen Elemente erhalten werden. Rhodium ist das teuerste Element der Platingruppe, wobei der Preis stark von der Marktlage abhängt. Im Januar 2016 lag der Preis für die Feinunze bei 660 US$, während im Januar 2015 noch etwa 1200 US$ zu zahlen gewesen wären.
Tatsächlich kann anhand der Geschichte zur Entdeckung von Rhodium im Jahr 1804 durch den Engländer William Hyde Wollaston – auf dessen Konto auch die Entdeckung des Elements Palladium geht – die gegenwärtige Gewinnung des Elements sehr gut nachvollzogen werden: Wollaston kaufte am Weihnachtstag des Jahres 1800 zusammen mit seinem Geschäftspartner Smithson Tennant (dem Entdecker von Osmium und Iridium) 5959 Feinunzen (ca. 185 kg) Alluvial-Rohplatin („angeschwemmt“) für einen Preis von 795 Pfund. Das Material stammte ursprünglich wahrscheinlich aus dem heutigen Kolumbien, hatte einen ungefähren Platingehalt von 80% und wurde über Jamaika nach England geschmuggelt. Wollaston und Tennant beabsichtigten dabei, den Produktionsprozess für schmiedbares Platin zu optimieren. Nachdem sie das Rohmaterial mit Königswasser behandelt hatten, blieben kleine Mengen an unlöslichem schwarzem Material zurück, das – wie Tennant später zeigen konnte – Osmium und Iridium enthielt. Wollaston wandte sich dem gelösten Teil zu, entfernte durch Zugabe von NH4Cl den Großteil des Platins in Form von (NH4)2[PtCl6] und versetzte die restliche Lösung mit Zink, um das verbliebene Platin, Palladium, Rhodium, Kupfer und Blei in elementarer Form abzuscheiden. Kupfer und Blei konnte er durch Reaktion mit verdünnter Salpetersäure abtrennen, bevor er den verbliebenen Rückstand wiederum in Königswasser auflöste. Nach Zugabe von NaCl konnte nach Entfernung der flüssigen Bestandteile die rote Verbindung Na3[RhCl6] • nH2O erhalten werden. Nach Aufreinigung und abschließender Reduktion mit Zink konnte er Rhodium in reiner Form darstellen. Seine Ergebnisse und somit die Entdeckung des neuen Elements wurden im Jahr 1804 veröffentlicht.[2]

Abb. 1: Fotos von RhCl3 • 3H2O und elementarem Rhodium (Ausstellungsstück Fachbereich für Anorganische Chemie, Freie Universität Berlin, Fotos: M. Ahrens)
Wollaston selbst entwickelte die erste industrielle Anwendung für das neu entdeckte Element, indem er um 1820 eine Rhodium-Zinn-Legierung als geeignetes Material für langlebige Füllfederspitzen erkannte. Diese Spitzen wurden zu einem Preis von einem Sixpence pro Stück verkauft (bevor sie von härteren Osmium-Iridium-Legierungen abgelöst wurden). Neben dieser und anderer Anwendungen wurden im Laufe des 19. Jahrhunderts aufgrund seiner Materialeigenschaften auch erste Anwendungen von Rhodium auf dem Gebiet der Heterogenen Katalyse beschrieben.[2]
Auch heute findet Rhodium aufgrund seiner herausragenden mechanischen Eigenschaften noch als Legierungsbestandteil Anwendung, beispielsweise in Form von Platin/Rhodium-Tiegeln und Platin/Rhodium-Thermoelementen. Auch Weißgold wird in der Regel abschließend rhodiniert, um ein „weißeres“ Erscheinungsbild zu erreichen.
Interessantes und Hilfreiches
Wie bereits erwähnt, gehört auch das ebenso seltene Element Iridium zur Gruppe der Platinmetalle und steht im Periodensystem direkt unter Rhodium. Iridium erlangte im Jahr 1980 Bedeutung bei der Frage nach dem Grund für das globale Massensterben zur Zeit der Kreide-Tertiär-Grenze vor 65 Millionen Jahren, von dem auch die bisher größten Landwirbeltiere, die Dinosaurier, betroffen waren. Lewis W. Alvarez (Nobelpreis für Physik 1968) und seinem Sohn Walter war es möglich, in der diesem Zeitraum zuzuordnenden Schicht einer Gesteinsformation in Gubbio (Italien) ungewöhnlich hohe Konzentrationen an insbesondere Iridium nachzuweisen (Stichwort: Iridium-Anomalie).[3] Da ihre Ergebnisse auch mit Messungen an Sedimentgesteinen aus Dänemark übereinstimmten, und bekannt war, dass der Iridiumgehalt in Meteoriten und Asteroiden besonders hoch ist, stellten sie die Hypothese auf, dass der Einschlag eines großen Asteroiden der Auslöser für das Massensterben vor 65 Millionen Jahren war. Dies wurde erst viele Jahre später, unter anderem durch die Identifikation des zugehörigen Einschlagskraters nahe der Yukatan-Halbinsel, akzeptiert. Der Gehalt an Rhodium in den zugehörigen Schichten – der auch stark erhöht ist – konnte ebenfalls als unterstützendes Argument herangezogen werden, da ein Rh/Ir-Verhältnis gefunden wurde, das dem Verhältnis der beiden Elemente im Kosmos entspricht.[4]
Neben dieser geologischen Bedeutung des Elements Rhodium sei hier noch auf eine Anwendung im Rahmen der Analytischen Chemie hingewiesen. Wie bereits erwähnt, kommt Rhodium als Reinelement in Form des Isotops 103Rh vor und besitzt einen Kernspin von I = ½. Folglich eignet sich 103Rh optimal für Untersuchungen im Rahmen der Kernspinresonanz-Spektroskopie. Leider findet die 103Rh-NMR-Spektroskopie aufgrund der geringen Empfindlichkeit und der damit verbundenen langen Messzeiten bisher nur bedingt Anwendung. Andererseits können durch die Rh-Kopplung zu anderen Kernen oft wichtige Aussagen insbesondere in der Metallorganischen Chemie getroffen werden.[5]
Der 3-Wege-Katalysator
Die Idee eines 3-Wege-Katalysator lässt sich bis zu einem Patent aus dem Jahr 1963 zurückverfolgen. Das Element Rhodium wurde 1975 als nützlicher Bestandteil identifiziert und ist seit 1979 essentieller Bestandteil im Automobilbereich. Grundsätzlich dient der 3-Wege-Katalysator der katalytischen Abgasbehandlung und sein Aufbau hat sich in den letzten Jahrzehnten kaum verändert: Der Abgasstrom wird durch ein Bauteil mit Wabenstruktur geleitet, wobei das gesamte Bauteil mit einem porösen Material, dem sogenannten „Washcoat“, beschichtet ist. Der Washcoat besteht aus γ-Al2O3 (bis zu 85%) mit hoher spezifischer Oberfläche als Trägermaterial und meist einem Seltenerdoxid wie CeO2. Lediglich 1-2% des Washcoats fallen den katalytisch aktiven Metallen Platin, Palladium und Rhodium zu. Hierbei ist es möglich, Platin vollständig durch (billigeres) Palladium zu ersetzen, Rhodium muss allerdings tatsächlich als integraler Bestandteil angesehen werden. Als Grund hierfür wird die besondere Reaktivität des Rhodiums gegenüber NO an der Katalysatoroberfläche angesehen.[6] 80-90% des weltweiten Rhodium-Angebots werden von der Automobilindustrie beansprucht.
Aktuelle Forschung und Anwendung
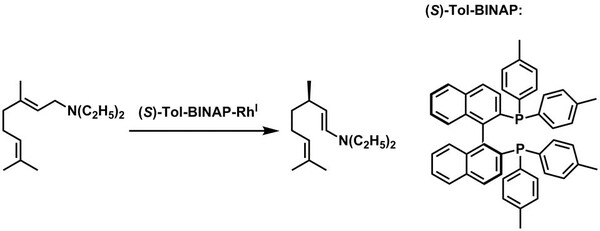
Abb. 2: Rhodium-katalysierte Isomerisierungsreaktion von N,N-Diethylgeranylamin zu (R)-Citronellalenamin als Bestandteil der industriellen Mentholsynthese. (Thomas Braun, HU Berlin)
Das Element Rhodium findet in der Homogenen Katalyse seine Anwendung. Industriell spielt es z.B. im Rahmen der Synthese von L-Menthol eine zentrale Rolle, da ein kationischer RhI-Komplex einen dort enthaltenen asymmetrischen Isomerisierungsschritt mit einer extrem hohen Umsatzzahl von bis zu 400.000 (insgesamt; nach der Maximalzahl an Durchläufen) katalysiert (Abb. 2).[7] Entsprechend hat Rhodium eine große Bedeutung für die kosmetische Industrie.
Dieser Reaktionsschritt ist ein Beispiel aus dem Bereich der katalytischen asymmetrischen Synthese, die auch im Allgemeinen eng mit dem Element Rhodium verknüpft ist. Hierbei sei erwähnt, dass seit Beginn der Forschungsbemühungen auf diesem Gebiet auch die beiden Platingruppenmetalle Ruthenium und Osmium eine große Rolle spielen. Die Bedeutung der Entwicklung stereoselektiver Katalysen – u.a. unter Verwendung von Rhodiumverbindungen – lässt sich daran ablesen, dass der Nobelpreis 2001 zur Hälfte an die Pioniere auf diesem Gebiet – William S. Knowles und Ryoji Noyori – für ihre Arbeiten im Rahmen chiral-katalysierter Hydrierungsreaktionen verliehen wurde. Der erste effiziente homogene Hydrierungskatalysator war der sogenannte Wilkinson-Komplex [RhCl(PPh3)], benannt nach Geoffrey Wilkinson, dem Chemie-Nobelpreisträger des Jahres 1973.
Aus industrieller Sicht muss natürlich auch das Ostwald-Verfahren zur Herstellung von Salpetersäure genannt werden: Zur Oxidation von Ammoniak durch Luftsauerstoff werden hier Platin/Rhodium-Netze als heterogene Katalysatoren eingesetzt. Des Weiteren werden metallorganische Rhodiumverbindungen großtechnisch als homogene Katalysatoren in der Hydroformylierung (Oxosynthese) von Olefinen verwendet. Auch im Monsanto-Prozess zur Synthese von Essigsäure ausgehend von Methanol und Kohlenmonoxid ist ein anionischer RhI-Komplex die katalytisch aktive Spezies.
Aus Sicht der Katalyseforschung stehen auf dem Gebiet der Rhodiumchemie ebenfalls metallvermittelte Bindungsaktivierungsreaktionen im Vordergrund. Einige Beispiele sollen im Folgenden kurz erwähnt werden: Von der Arbeitsgruppe um Hartwig konnte beispielsweise gezeigt werden, dass ein RhI-hydroxido-Katalysatorvorläufer in Kombination mit sterisch anspruchsvollen Bisphosphanliganden dazu in der Lage ist, aromatische C–H-Bindungen zu aktivieren und in einer Reaktion mit Silanen zu silylieren (Abb. 3, Gleichung (1)).[9] Auch die katalytische Borylierung von C-H-Bindungen mit Hilfe von Iridium- und Rhodiumverbindungen hat in den letzten Jahren verstärkt Eingang in die Synthesechemie gefunden und ist u.a. mit den Namen Marder, Hartwig und Smith verknüpft.[10] Ein weiteres, potentiell auch großtechnisch interessantes Beispiel für eine Rhodium-vermittelte C–H-Aktivierungsreaktion ist die vor kurzem erschienene Arbeit der Gruppen um Cundari und Gunnoe: Hier wurde mit Hilfe eines elektronenarmen RhI-Komplexes in Kombination mit Cu(OAc)2 als Oxidationsmittel ein direkter Weg zur Synthese von Styrol ausgehend von Benzol und Ethen gefunden (Abb. 3, Gleichung (2)).[11]
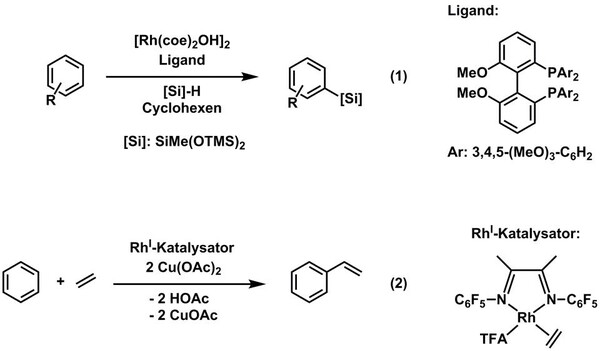
Abb 3: C–H-Bindungsaktivierung mit RhI-Komplexen. (Thomas Braun, HU Berlin)
In Matrixstudien konnten Perutz et al. zeigen, dass der RhI-Komplex [Rh(C5H5)(PMe3)] dazu in der Lage ist, Methan zu aktivieren.[12] Der Gruppe um Brookhart wiederum gelang durch Protonierung des Methylliganden eines RhI-Pinzettenkomplexes die Synthese und strukturelle Charakterisierung eines nichtklassischen Methankomplexes.[13] Eine katalytische Hydrodefluorierung – also die Umwandlung einer C–F- in eine C–H-Bindung – erreichten Milstein et al. mit der RhI-Verbindung [Rh(C6F5)(PMe3)] und (EtO)3SiH als Hydridquelle (Abb. 4).[14] Im Rahmen einer S–F-Bindungsaktivierung konnten wiederum RhI-Hydridokomplexe erfolgreich für den katalytischen Abbau des Treibhausgases SF6 unter sehr milden Bedingungen eingesetzt werden.[15] Dabei wurden Phosphane und Hydrosilane eingesetzt, um die Schwefel- und Fluoratome der SF6-Moleküle selektiv in nicht-gasförmigen und ungiftigen Produkten zu binden.
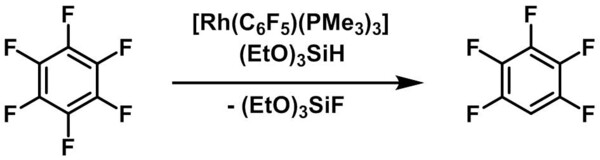
Abb 4: C–F-Bindungsaktivierung mit RhI-Komplexen. (Thomas Braun, HU Berlin)
Aktuell rückt Rhodium auch in den Fokus der Medizinischen Chemie, da erkannt wurde, dass Verbindungen dieses Elements interessante therapeutische Wirkungen entfalten können. Hierbei sei zu erwähnen, dass die bisherigen Studien auf diesem Gebiet insbesondere auf die Platingruppenmetalle Platin (Stichwort: cis-Platin als Anti-Krebs-Therapeutikum) und Ruthenium aufbauen. Durch gezielte Ligandentwicklung konnte gezeigt werden, dass auch Rhodiumverbindungen hinreichend labil sein können, um eine biologische Aktivität zu zeigen. So konnte mit [Rh(ppy)2(H2O)2]+ (ppy = 2-Phenylpyridin) ein kationischer RhIII-Komplex identifiziert werden, der die β-Amyloid-Aggregation effizient verhindert, was ihn zu einer potenten Verbindung im Rahmen der Alzheimer-Therapie macht. Dirhodium(II)-Komplexe (Rh24+) wurden schon früh als mögliche Anti-Krebs-Therapeutika ins Gespräch gebracht, und aktuelle Forschungsergebnisse konnten deren Potential bekräftigen und sogar erweitern.[16]
N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2. Aufl., Elsevier, Oxford, 1997, S. 1115.
W. P. Griffith, Platinum Metals Rev. 2003, 47, 175.
L. W. Alvarez, W. Alvarez, F. Asaro, H. V. Michel, Science 1980, 208, 1095.
G. I. Bekov, V. S. Letokhov, V. N. Radaev, D. D. Badyukov, M. A. Nazarov, Nature 1988, 332, 146.
L. Öhrström, Nature Chem. 2016, 8, 90.
M. Shelef, G. W. Graham, Catal. Rev. – Sci. Eng. 1994, 36, 433.
K. Sumi, H. Kumobayashi, Topics Organomet. Chem. 2004, 6, 63.
J. A. Osborn, F. H. Jardine, J. F. Young, G. Wilkinson, J. Chem. Soc. A 1966, 1711.
C. Cheng, J. F. Hartwig, Science 2014, 343, 853.
I. A. I. Mkhalid, J. H. Barnard, T. B. Marder, J. M. Murphy, J. F. Hartwig, Chem. Rev. 2010, 110, 890.
B. A. Vaughan, M. S. Webster-Gardiner, T. R. Cundari, T. B. Gunnoe, Science 2015, 348, 421.
M. G. Partridge, A. McCamley, R. N. Perutz, J. Chem. Soc. Dalton Trans. 1994, 3519.
W. H. Bernskoetter, C. K. Schauer, K. I. Goldberg, M. Brookhart, Science 2009, 326, 553.
M. Aizenberg, D. Milstein, Science 1994, 265, 359.
L. Zámostná, T. Braun, Angew. Chem. 2015, 127, 10798.
D.-L. Ma, M. Wang, Z. Mao, C. Yang, C.-T. Ng, C.-H. Leung, Dalton Trans. 2016, 45, 2762.

Prof. Dr. Thomas Braun
Institut für Chemie, Humboldt-Universität zu Berlin

Dr. Mike Ahrens
Institut für Chemie, Humboldt-Universität zu Berlin
Titelfoto: Dschwen, Rhodium foil and wire, CC BY-SA 3.0
Dieser Beitrag wurde auf FaszinationChemie erstmalig veröffentlicht am 17.06.2019.

Kommentare
Keine Kommentare gefunden!