Seltenen Erkrankungen
an den genetischen Kragen:
Gentherapie im Einsatz gegen Zellgift

Folge 15: Aktuelle Chemie 2019 – Medizin und Gesundheit
Viele Rückschläge hat sie einstecken, viele Zweifler überzeugen müssen, doch heute ist sie immer häufiger im Einsatz: die Gentherapie. Noch in den Kinderschuhen steckend, hilft sie bereits einigen Patienten auf unterschiedlichen Einsatzgebieten, die ohne sie keine Chance auf Therapie und damit oft auch auf Überleben hätten. Besonders von dem Fortschritt genbasierter Therapien profitieren die Onkologie sowie die Behandlung Seltene Erkrankungen – laut einer Prognose des Massachusetts Institute of Technology MIT und Statista werden 45 % der bis 2022 weltweit zugelassenen Gentherapeutika dem Therapiegebiet der Onkologie und 34 % dem Seltener Erkrankungen zuzuordnen sein.
Ein steiniger Weg
Seit den 1960er Jahren ist das Gebiet der Gentherapie Gegenstand der Forschung; 1990 wurde die erste klinische Studie einer Gentherapie am Menschen genehmigt, die Entschlüsselung weiter Teile des Humangenoms im Jahr 2001 schufen weitere Voraussetzungen. Viele Fortschritte wurden in der Zeit gemacht, es gab jedoch auch tragische Rückschläge, da das Einschleusen von DNA durch manipulierte Viren zum Teil schwere Immunreaktionen und Tumorwachstum hervorrief. Diese Faktoren hat man inzwischen besser unter Kontrolle, sodass die Europäische Union (EU) 2012 schließlich das erste Gentherapeutikum zuließ: Glybera, das gegen eine extrem seltene Stoffwechselerkrankung eingesetzt wurde. Inzwischen ist das Medikament zwar nicht mehr am Markt, da es sich aufgrund der extremen Seltenheit der Erkrankung nicht mehr rentierte; doch hat es den Weg geebnet für die Zulassung von Gentherapien in der EU. Seitdem gilt ein spezifisches Zulassungsverfahren für neuartige Therapien (ATMP – advanced therapy medicinal products), das neben Gentherapeutika auch somatische Zelltherapeutika und biotechnologisch bearbeitete Gewebeprodukte umfasst. Bis September 2018 wurden in der EU fünf Gentherapeutika zugelassen. Die zweite Gentherapie wurde vier Jahre nach Glybera auf den Markt gebracht: Strimvelis – ein Medikament gegen die seltene Erkrankung ADA-SCID, einem schweren kombinierten Immundefekt (engl. Severe Combined Immunodefficiency), der durch das Fehlen des Enzyms Adenosin-Desaminase (ADA) verursacht wird.
ADA im Einsatz
Die Adenosin-Desaminase ist ein Enzym, das für das Recycling von einer der vier DNA- und RNA-Bausteine verantwortlich ist. In der Klassifizierung der Enzyme handelt es sich um eine Aminohydrolase – ein Enzym, das die Abspaltung einer Aminogruppe unter Verwendung von Wasser katalysiert. ADA katalysiert im Speziellen die Desaminierung von Adenosin und Desoxyadenosin zu Inosin, Desoxyinosin und Ammoniak.
Damit ist ADA ein wichtiger Bestandteil des Recyclings der Purinnukleotide. Es kommt in allen Geweben vor, besonders aber in lymphatischen Organen, wo es eine wichtige Rolle bei der Immunreaktion spielt.
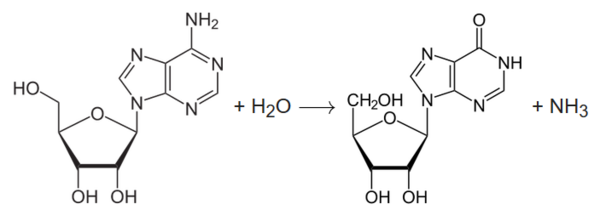
ADA katalysiert die Desaminierung von Adenosin und Desoxyadenosin zu Inosin, Desoxyinosin und Ammoniak.
ADA-SCID – ein schwerwiegender Defekt
Bei einigen wenigen Menschen ist das Gen, das für ADA codiert und auf Chromosom 20 liegt, defekt oder gar nicht vorhanden, sodass das Enzym nur sehr wenig oder gar nicht gebildet wird. Dadurch sammeln sich Adenosin und ähnliche Metabolite (wie z.B. dATP) innerhalb und außerhalb der Zellen an und blockieren verschiedene Stoffwechselwege. Für T-Lymphozyten, Abwehrzellen des Immunsystems, wirkt Adenosin zytotoxisch und auch die Produktion von weiteren Bestandteilen des Immunsystems wie B-Lymphozyten und natürlichen Killerzellen ist drastisch reduziert. Das hat schwerwiegende Folgen: Krankheitserreger können sich ungehindert ausbreiten und somit schwere Infektionen verursachen, die vom Körper selbst fast gar nicht bekämpft werden.
Darüber hinaus sind die DNA-Synthese und -Reparatur sowie Stoffwechselwege in verschiedenen Geweben gestört, sodass die Betroffenen unter vielen weiteren Beschwerden wie Hörverlust, Wachstums- und Entwicklungsstörungen sowie Leber- und Nierenproblemen leiden. Da die Erkrankung genetische Ursachen hat, treten die Symptome meist in den ersten sechs Lebensmonaten auf. Ohne Therapie liegt die Lebenserwartung der Kinder bei maximal zwei Jahren. Die Erkrankung, die autosomal rezessiv vererbt wird, zählt zu den Seltenen Erkrankungen. EU-weit treten jährlich etwa 15 Fälle auf.
Eingefärbte elektronenmikroskopische Aufnahme eines T-Lymphozyten (Bildquelle: NIAID auf flickr.com: https://www.flickr.com/photos/niaid/16760076824)
Behandlung von ADA-SCID
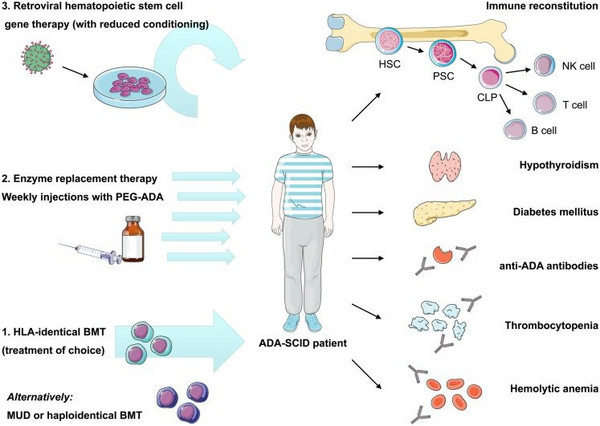
Da die Erkrankung auf ein einzelnes nicht funktionierendes Gen bzw. ein nicht vorhandenes Enzym zurückzuführen ist, gibt es verschiedene Behandlungsmethoden: Die erste Wahl ist eine Knochenmarkspende. Durch die Transplantation intakter Knochenmarkzellen kommt so das fehlende Gen in den Körper, der das Enzym dadurch wird wieder produziert. Doch nur für etwa ein Viertel der Patienten steht ein passender Spender zur Verfügung. Das Injizieren des fehlenden Enzyms ist auch möglich, muss aber ständig wiederholt werden und die Wirkung lässt über die Jahre nach. Viele betroffene Kinder lebten zur Minimierung des Infektionsrisikos in vollständiger Isolation. Ohne Knochenmarkspender war die Lebenserwartung gering.
Gentherapie aus Mailand hilft ADA-SCID-Patienten
Seit einigen Jahren besteht nun die Möglichkeit einer Gentherapie, wenn es keinen passenden Knochenmarkspender gibt. Über 20 Jahre Entwicklungszeit hat es gebraucht – entwickelt wurde die Therapie namens Strimvelis von Forschern des San Raffaele Telethon Institute for Gene Therapy (SR-TIGET). Unter ihnen Professor Alessandro Aiuti, der Ende der 90er Jahre der Forschergruppe unter der Leitung von Claudio Bordignon beigetreten ist und seitdem die Entwicklung der Therapie und die klinischen Studien durchgeführt und begleitet hat. 2010 ging das Pharmaunternehmen GalaxoSmithKline (GSK) mit der Telethon-Stiftung und dem beteiligten Krankenhaus San Raffaele in Mailand eine strategische Zusammenarbeit ein, trieb das Projekt weiter voran und stellte den Zulassungsantrag in der EU, dem im September 2016 stattgegeben wurde. Seit 2018 liegt das Gentherapie-Portfolio für Strimvelis bei Orchard Therapeutics, einer britisch-US-amerikanischen Biotechfirma, die sich auf die Entwicklung von Gentherapien vor allem für Seltene Erkrankungen spezialisiert hat. GSK bleibt mit 19,9 % Anteilseigner. Verabreicht werden darf Strimvelis aktuell nur am Institut San Raffaele Telethon für Gentherapie (SR-Tiget) in Mailand. „Die Therapie basiert auf patienteneigenen lebendigen Zellen, deren DNA modifiziert wurde“, erklärt Professor Aiuti, Vizedirektor des SR-Tiget und Chefarzt für Pädiatrische Immunohämatologie des San Raffaele Krankenhauses. „Damit die Zellen überleben, müssen sie dem Patienten innerhalb eines sehr kurzen Zeitfensters wieder injiziert werden. Deshalb muss das Therapiezentrum an ein entsprechend qualifiziertes zellverarbeitendes Labor angeschlossen sein. Die Zellverarbeitung für Strimvelis wird von Molmed durchgeführt, ein biotechnologisches Labor, das auf unserem Campus liegt und aufgrund der hohen Spezifität der Behandlung aktuell das einzig zugelassene Labor für die Herstellung von Strimvelis ist.“
Die Therapie: Eigene Zellen – verbesserte DNA
Strimvelis enthält Zellen, die aus dem patienteneigenen Knochenmark stammen. Einige der Zellen (sog. CD34+-Zellen – unreife Zellen, die Lymphozyten bilden können) enthalten gentechnisch veränderte DNA, die das funktionierende Gen für ADA trägt. Eingefügt wird die fehlende DNA-Sequenz vorher außerhalb des Körpers (ex vivo) mithilfe eines Virustyps, der gentechnisch so verändert wurde, dass er das ADA-Gen in die Zelle transportiert, ohne eine Virusinfektion hervorzurufen. Die Zellen mit reparierter DNA werden dem Patienten intravenös verabreicht. Sie werden über die Blutbahn zum Knochenmark transportiert, wo sich die CD34+-Zellen vermehren und normale Lymphozyten bilden, die ADA produzieren können.
Ein Video der Telethon-Stiftung zur Entwicklung und Wirkungsweise von Strimvelis:
Vielversprechende Ergebnisse
„33 Patienten aus 14 verschiedenen Ländern, wie Kanada, Venezuela, Ägypten und Deutschland, haben wir bisher mit der Gentherapie behandelt – das umfasst sowohl die Patienten der ersten klinischen Studien als auch die Patienten, die seit der Marktzulassung behandelt wurden“, berichtet Professor Aiuti. „Alle Patienten sind immer noch am Leben und bei fast 80 % hat die Behandlung so angeschlagen, dass keine Ersatztherapie benötigt wird.“ Die Behandlung mit Strimvelis hat eine ganze Reihe an Nebenwirkungen, doch kam der Ausschuss für Humanarzneimittel (CHMP) zu dem Schluss, dass der Nutzen gegenüber den Risiken überwiegt. Bisher scheinen die Ergebnisse vielversprechend, aber da noch keine Langzeitstudien existieren, ist weiteres Monitoring vonnöten. „Wir haben die Therapie durch die Entwicklung innovativer Techniken immer weiter verbessert und arbeiten weiter daran, Gentherapien immer effektiver und sicherer zu machen. Wir erforschen weitere Einsatzfelder genetischer Therapien und hoffen, dass dadurch noch vielen Patienten mit Erkrankungen mit hohem medizinischem Bedarf geholfen werden kann.“ Auch an der Methode der Kryokonservierung für genetisch verarbeitete Zellen wird gearbeitet, um die Zellen mithilfe flüssigen Stickstoffs einfrieren und an einen anderen Ort transportieren zu können. So könnte die Therapie schließlich auch an weiteren Zentren durchgeführt werden.
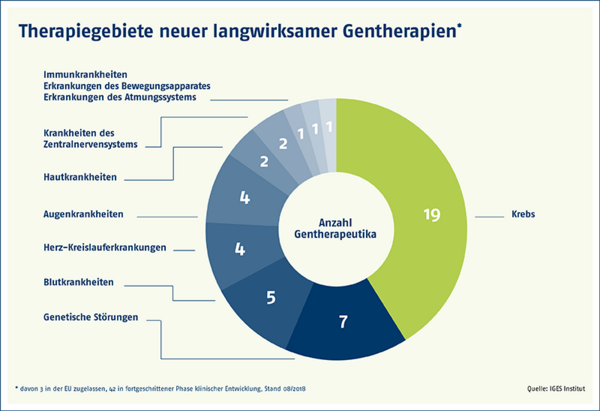
Die Zahl genetischer Therapien wird in den kommenden Jahren stark zunehmen. Über 40 neue langwirksame Gentherapien stehen laut dem IGES-Institut, einem unabhängigen Forschungs- und Beratungsinstitut für Infrastruktur- und Gesundheitsfragen, kurz vor der Marktreife, da sie sich in späten Phasen der klinischen Entwicklung befinden.


Kommentare
Keine Kommentare gefunden!