Uran – das „schwarze Schaf“ unter den Elementen

2019 – Jahr des Periodensystems
Uran ist – neben dem nur in Spuren natürlich vorkommenden Plutonium – sicherlich das Element mit dem derzeit schlechtesten Ruf im Periodensystem. Wahrlich ein „schwarzes Schaf“, dessen Verwendung zu Forschungszwecken und Energiegewinnung bis zum heutigen Tag ein kontrovers und immer noch hoch emotional diskutiertes Thema ist, spätestens durch die furchterregenden Ereignisse von Tschernobyl (1986) und Fukushima (2011) sowie die politisch beschlossene Energiewende.
Obwohl die wirtschaftliche und wissenschaftliche Bedeutung von Uran als weitgehend CO2-neutraler Primärenergieträger weltweit immer noch immens (und zunehmend) ist, sind vor allem in Deutschland die negativen Assoziationen beim Stichwort „Uran“ und „Kernenergie“ weitreichend und längst in Forschung und Lehre angekommen. In der Folge leiden die Akzeptanz der akademischen Uranforschung und das Interesse rund um dieses Element. Allerdings wäre gerade jetzt, nach dem politisch beschlossenen Atomkraftausstieg, eine erhöhte Sichtbarkeit und Popularität der Uranforschung wünschenswert, um neben der wichtigen akademischen Grundlagenforschung auch Entsorgungstechniken, Weiterverwertung und Aufarbeitung von Nuklearindustrieabfällen (hier besonders des Rohstoffs, des „abgereicherten“ Urans, siehe unten) zu erforschen.
Zum Glück haben jedoch auch schwarze Schafe treue Freunde und die Anzahl derer, die sich begeistert mit der vielfältigen Uran-Chemie beschäftigen, steigt. Als Folge sorgt auch die spannende Uran-Synthesechemie nun schon seit gut zwei Jahrzehnten für wissenschaftliche Highlights.[1,2]
Historie der Entdeckung
Uran – vom Erz ins Kernkraftwerk
Das Element Uran (Ordnungszahl Z = 92) hat die höchste Atommasse und Kernladung aller natürlich vorkommenden Elemente. Von den 17 bekannten Uranisotopen (J. Emsley, The Elements) kommen heute nur noch drei Isotope in nennenswerten Mengen natürlich vor: 234U (0,0054%), 235U (0,7204%) und 238U (99,2742%). Diese natürlich vorkommenden Isotope des Urans sind allesamt radioaktive a-Strahler mit Halbwertszeiten von 0,25 (234U) und 704 Mio. (235U) bis 4.47 Mrd. Jahren (238U). Uran kommt in der Natur niemals gediegen (elementar, rein) vor, sondern stets in sauerstoffhaltigen Uranmineralien, wie z.B. in der Pechblende, dem Uran(IV)oxid, UO2. Die in Bergwerken geförderten Erze des Urans werden nach dem Mahlen und Rösten sauer (H2SO4) oder alkalisch (Na2CO3) aufgeschlossen und die entstehenden Uranylkomplexe über Anionentauscher oder Lösungsmittelextraktion gereinigt. Nach dem Auswaschen wird mit Ammoniak der sogenannte „yellow cake“ ausgefällt, eine Mischung aus verschiedenen Polyuranaten, deren Hauptbestandteil das gelbe Ammoniumdiuranat (NH4)4U2O7 ist. Der „yellow cake“ kann vor dem Transport zum Uranoxid gebrannt werden, um Gewicht zu sparen. Dieses Oxid (oder auch der „yellow cake“ direkt) wird zur Urananreicherung zunächst in konzentrierter Salpetersäure gelöst. Hierbei bildet sich das Uranylkation UO22+, welches als Uranylnitrat-Hexahydrat, UO2(NO3)2∙6H2O, kristallisiert werden kann. Das Uranylnitrat wird pyrolysiert, woraufhin reines UO3 erhalten wird, das mit Wasserstoff bei hohen Temperaturen zum UO2 reduziert wird. Da nur das 235U mit thermischen Neutronen spaltbar ist und eine Kettenreaktion unterhält, muss zur Herstellung von Nuklearbrennstoff im nächsten Schritt das 235Uran, das in natürlichem Uran heutzutage nur noch zu ca. 0,7 % vorliegt, auf den in Kernkraftwerken benötigten Anteil von 3 − 5 % angereichert werden. Dazu wird UO2 zuerst mit Fluorwasserstoffgas, HF, in das grüne Urantetrafluorid UF4 („green salt“, Abb. 1, links) und anschließend durch die Oxidation mit elementarem Fluorgas, F2, in das farblose Uranhexafluorid, UF6, überführt (Abb. 1, rechts), das bei einer Temperatur von nur 56,2 °C sublimiert und ein stabiles Gas bildet. Da Fluor ein Reinelement (100% 19F) ist, sind die Gewichtsunterschiede in UF6 allein auf die Massendifferenzen der Uran-Isotope zurückzuführen und eine Auftrennung nach Massen ist möglich.

Die gebräuchlichste Methode der 235U Anreicherung ist die Gaszentrifugation, bei der das UF6-Gas der 238Uran-Verbindung aufgrund ihrer höheren Molekülmasse stärker nach außen getragen, als das der 235Uran-Verbindung, das im Zentrum abgeführt werden kann. Durch wiederholtes Zentrifugieren kann so eine nahezu beliebig hohe Anreicherung erzielt werden. Für die zivile Nutzung in Kernkraftwerken beträgt die Anreicherung z.B. 3 bis 5%, für die militärische Nutzung 25% (weapons usable) bis 85% (weapons grade) oder bis zu 100% als Ausgangsmaterial z.B. für die Synthese von CardioliteÒ, einem nuklear-medizinischen Technetium-Kontrastmittel (99mTc) zur diagnostischen Herz- und Herzkranzgefäßdarstellung. So entsteht in der Zerfallsreihe 235U " 99Mo " 99mTc das metastabile und daher kurzlebige 99mTc (Halbwertszeit 6 h), welches mit jährlich über 25 Millionen Anwendungen ein wichtiges Radiopharmazeutikum für diagnostische Verfahren am Patienten ist.
Um das angereicherte Uran nutzbar zu machen, wird das hydrolyseempfindliche Uranhexafluorid wieder zum Uran(IV)oxid reduziert. Dazu wird UF6 mit Wasserdampf versetzt und unter Freisetzung von HF mit Wasserstoff bei 700oC reduziert. Das entstandene grau-schwarze Uran(IV)oxid wird anschließend in sogenannte Pellets gepresst und kann in dieser Form für die Produktion von Brennstoffelementen verwendet werden. Pro Tonne „Brennstoff“ mit einem 235U Anreicherungsgrad von 3 bis 5% entstehen dabei ca. 7 bis 8 Tonnen abgereichertes Uran (depleted uranium, DU).
Die Darstellung von metallischem Uran gelingt durch die Reduktion von Urantetrafluorid UF4 mit Calcium oder mit dem industriell vorwiegend verwendeten Aluminium und Magnesium (Ames-Process).
Uran – elektronische Eigenschaften
Das grundlegende und aktuell wieder steigende Interesse an der Chemie des Urans geht vor allem auf seine besondere Position innerhalb des Periodensystems und den daraus resultierenden physikalischen und chemischen Eigenschaften zurück, die sich von den schwereren Actinoiden (Am – Lr) aber auch von den Übergangsmetallen und Lanthanoiden deutlich unterscheiden.[3]
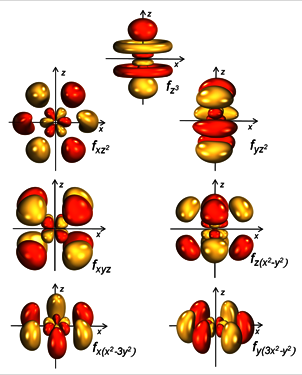
Die elektronischen Eigenschaften der früheren Actinoide (Th – Pu), zu denen auch das Uran gehört, sind in besonderem Maße durch die sogenannten „relativistischen Effekte“ beeinflusst. Durch die hohe Kernladung der Actinoiden werden die Elektronen der inneren s- und p-Schalen stärker vom Atomkern angezogen und bewegen sich dabei so schnell, dass ihre kinetische Energie unter Anwendung der speziellen Relativitätstheorie betrachtet werden muss. Die gravitationsbedingte Zunahme der Elektronen-Kern-Anziehung führt zu einer Kontraktion der inneren s- und p-Orbitale und einer teilweisen Abschirmung der positiven Kernladung. Die Folge davon ist eine radiale Orbitalexpansion der 5f-Orbitale der frühen Actinoide und, im besonderen Fall von Uran, nähern sich dabei die 6d- und 5f-Orbitale gerade soweit energetisch an, dass die Energieniveaus nahezu identisch sind und die Orbitale leicht hybridisieren (lat. Hybrida = Mischling, hybridisieren = mischen) können.[3] Der Einfluss der abschirmenden Wirkung der Elektronen wird jedoch mit weiter zunehmender Kernladung der späteren Actinoiden immer geringer, so dass die Orbitalenergien der schwereren Actinoide dann wieder weiter auseinander liegen. Für elementares Uran ergibt sich die Elektronenkonfiguration [Rn]5f36d17s2 mit eng beieinander liegenden 6d- und 5f-Orbitalen, die Hybridorbitale zur Bindung in Uranverbindungen ausbilden können. Durch die energetisch sehr ähnlichen Orbitale können Uran-Ionen auch eine ungewöhnlich weite Spanne von Oxidationsstufen annehmen – im Falle von Uran von +2 bis +6. Die Anzahl und Anordnung von Liganden (Ligand kommt von lat. ligare = „binden“ und ist ein Atom oder Molekül, welches an ein zentrales Metall-Ion binden kann) werden durch die zahlreichen f-Orbitale (Abb. 2) des Metalls bestimmt, so dass ungewöhnlich hohe Bindungszahlen mit den umgebenden Liganden (für Uran bis zu 15) und eine Vielfalt an Molekülstrukturen vorkommen. Dies erlaubt den Einsatz von Chelatliganden (Liganden mit zwei oder mehr Bindungsstellen, von griech. chele = Krebsschere abgeleitet) zur Bildung von löslichen, reaktiven Uranverbindungen mit verfügbaren freien Reaktionsstellen für die Umwandlung von z.B. N2 zu Ammoniak, H2O zur H2 (und O2 Produktion) oder CO und CO2 für die Synthese von flüssigen Treibstoffen (s.a. Fischer-Tropsch-Synthese).[1,2] Die elektronenreichen und oxophilen Uran-Ionen in derart stabilisierten Uranverbindungen erlauben die reduktive Aktivierung und Umsetzung von diesen sonst nur schwer zur Reaktion zu bringenden kleinen Molekülen.
Uran – Koordinationschemie
Die Koordinations- oder auch Komplexchemie (von lat. complexum = umgeben, umarmt, umklammert) ist ein wichtiges Teilgebiet der Anorganischen Chemie, welches sich – im hier diskutierten Fall – mit löslichen Uranverbindungen beschäftigt, die aus einem zentralen Uran-ion und mehreren umgebenden Liganden bestehen. Aufgrund der Verfügbarkeit der ausreichend in der Erdkruste vorkommenden Rohmaterialien und der einfachen Handhabung beschränkt sich die synthetische Actinoidenforschung an den Universitäten ganz allgemein vor allem auf die schwachen α-Strahler Thorium und Uran. So ist z.B. durch die leicht abschirmbare a-Strahlung der Umgang mit Uran für Chemiker mit wenigen Sicherheitsvorkehrungen gefahrlos möglich (a-Strahlung kann z.B. schon durch ein einfaches Blatt Papier abgeschirmt werden). Für die Synthesechemie nimmt das „abgereicherte“ Uran (> 99.3 % 238U, DU) – welches als Abfallprodukt bei der Anreicherung natürlich vorkommenden Urans für Nuklearbrennstoffe anfällt – eine Sonderstellung als wertvolle Ressource ein, da es wegen seiner geringen Radioaktivität gut handhabbar und in großen Mengen verfügbar ist.
Die „klassische“ Koordinationschemie des Urans ist noch relativ jung, da es lange Zeit keine geeigneten reaktiven Ausgangsverbindungen gab, die gut definiert und in gängigen organischen Lösungsmitteln löslich waren. Im Jahr 1979 wurde erstmalig ein rot-violetter U(III)-Komplex isoliert (Abb. 3, rechts), jedoch ist dessen direkte Synthese vergleichsweise aufwändig.[4] Erst die 1997 veröffentlichte Darstellung des blauen Komplexes (links) ermöglichte den „einfachen“ Zugang zur vielfältigen Uran-Koordinationschemie (Abb. 3).[5]
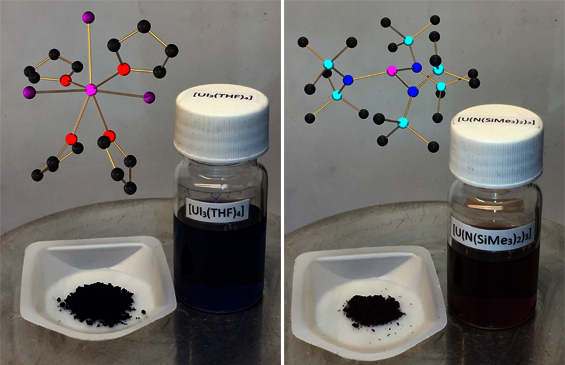
Um Uran für die Synthesechemie zugänglich zu machen, müssen „frisch“ produzierte Uranspäne (Abb. 4), aus einem Block zerspant, verwendet werden. Sollten nur an Luft gelagerte, oberflächlich oxidierte Uranspäne zur Verfügung stehen, müssen diese zunächst mit Salpetersäure gewaschen, gespült und getrocknet und anschließend amalgamiert werden. Dann versetzt man die reaktiven Späne in organischem Lösungsmittel (Tetrahydrofuran, THF) mit Iod, I2, und erhält nach längerem Rühren bei tiefen Temperaturen (ca. –30 °C) den wunderschönen, blauen U(III) Komplex [UI3(THF)4] (Abb. 3, links). Das darin stabilisierte Uran(III)-Ion ist ein außerordentlich reaktives Metallzentrum, das kreative Forscher vielfältig einsetzen, um. besonders unreaktive Moleküle regieren zu lassen, wie z.B. einfache Kohlenwasserstoffe, N2, CO, CO2 oder auch H2O.[1-3,6]

Uran – von der Koordinationschemie zur Katalyse
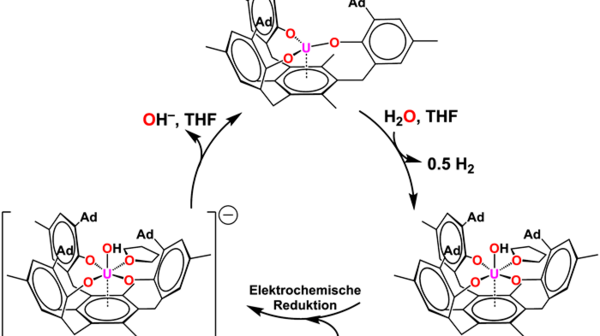
Aufgrund ihrer Oxophilie, starken Reduktionskraft und reaktiven Metall-Ligand Bindungen, erscheinen elektronenreiche Urankomplexe wie geschaffen für z.B. die wichtige Aufgabe der Energiegewinnung durch Wasserspaltung. Jedoch gelang es Forschern erst kürzlich, der H2-Gewinnung mit Hilfe von Uran durch elektrokatalytische Wasserspaltung einen grundlegenden Schritt näher zu kommen. Es gelang, aus dem im Überfluss vorhandenen, abgereicherten Uranmetall einen reaktiven Urankomplex in der Oxidationsstufe +III (Abb. 5) herzustellen, der in der Reaktion mit H2O unter Freisetzung von H2 eine Uran-Hydroxido-Spezies bildet und durch eine elektrochemische Reduktion zurück zum Ausgangskomplex des katalytischen Zyklus geführt werden kann. Es handelt sich bei diesem Zyklus um das erste bekannte Beispiel einer katalytischen Wasserstofferzeugung durch ein f-Element.[6]
Als Beispiel für die Umsetzung von sehr reaktionsträgen, kleinen Molekülen mit Hilfe von Urankomplexen sei letztlich noch die grundlegende Entdeckung einer stöchiometrischen Umwandlung von Luftstickstoff mit Wasserstoff) zu Ammoniak bei Raumtemperatur und Atmosphärendruck erwähnt.[7] Diese Reaktion von N2 und H2 zu NH3, in Gegenwart eines Katalysators, ist als Haber-Bosch-Verfahren bekannt, welches für die Synthese von Düngemitteln zur Versorgung einer stetig steigenden Weltbevölkerung von immenser Bedeutung ist. Auch die ermutigenden Entdeckungen der Uran-basierten CO2-Aktivierung und Reduktion zu CO sowie der CO-Hydrierung zur Herstellung von flüssigen Treibstoffen (z. B. Methanol) zeigen ebenfalls das immense Zukunftspotential der spannenden Uranchemie.
Literatur:
H. S. La Pierre, K. Meyer, Prog. Inorg. Chem. 2014, 58, 303-416.
A. R. Fox, S. C. Bart, K. Meyer, C. Cummins, Nature 2008, 455, 341-349.
Stephen T. Little, Angew. Chem. 2015, 127, 2-41.
R. A. Andersen, Inorg. Chem. 1979, 18, 1507-1509.
D. L. Clark, A. P. Sattelberger, R. A. Andersen, Inorg. Synth. 31, 307-315.
D. P. Halter, F. W. Heinemann, J. Bachmann, K. Meyer, Nature 2016, 530, 317-321.
M. Falcone, L. Chatelain, R. Scopelliti, I. Živkovi?, M. Mazzanti, Nature 2017, 547, 332-335.

Prof. Dr. Karsten Meyer, Dr. Christina Hauser
Inorganic & General Chemistry, Department of Chemistry & Pharmacy Friedrich-Alexander University of Erlangen-Nürnberg (FAU)
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.

Kommentare
Keine Kommentare gefunden!