Die Chemie von Bisphenol-A – unverzichtbarer Grundstoff für unser modernes Leben
In jüngster Zeit ist ein Inhaltsstoff von Lebensmittelverpackungen, der seit Jahrzehnten verwendet wird, stärker in den Fokus der Öffentlichkeit gerückt: Bisphenol-A (BPA). Einen ausführlichen Beitrag zur Diskussion um die gesundheitlichen Gefahren gibt es hier auf FaszinationChemie.
Synthese von Bisphenol-A (BPA)
Die Hauptkomponenten zur Herstellung von BPA sind Phenol und Aceton, die automatisch bei der Phenolsynthese nach dem Cumolverfahren [1] anfallen:
Zunächst wird Benzol aus der C6-Fraktion von Raffinerieprozessen mit Propen aus der C3-Fraktion nach der Friedel-Crafts-Alkylierung zu Isopropylbenzol umgesetzt. Die Alkylierung wird durch saure Ionenaustauscher katalysiert. Das gebildete Isopropylbenzol (Cumol) wird anschließend mit Sauerstoff zum Hydroperoxid umgesetzt, welches umlagert und schließlich zu Phenol und Aceton reagiert.
Für die BPA-Synthese schließlich werden zwei Teile Phenol mit einem Teil Aceton umgesetzt (Abb. 2). Dadurch entsteht bei der Cumolsynthese ein Überschuss an Aceton, der für andere Zwecke verwendet werden kann.
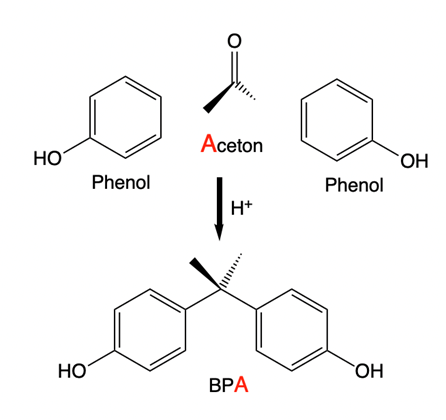
Abb. 2: Synthese von Bisphenol-A aus Phenol und Aceton (Abb. H. Ritter)
Diskussion um Gesundheitsgefahren von BPA
Die vermutete östrogene Wirkung von BPA wurde bereits im letzten Jahrhundert in Tierversuchen nachgewiesen, war aber nur relativ schwach ausgeprägt. Für eine gezielte Therapie bei Menschen mit Östrogenmangel ist BPA daher nicht geeignet.
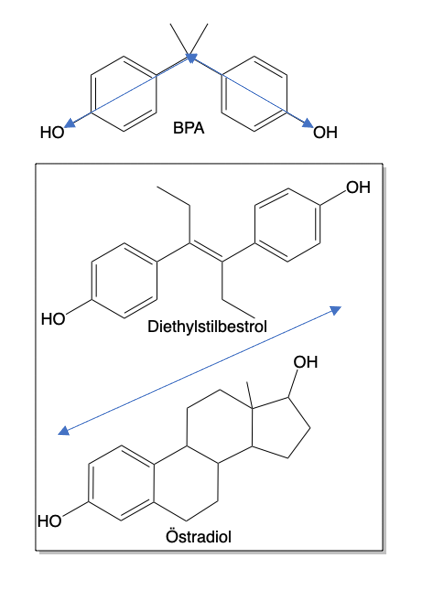
Betrachtet man die chemische Formel von BPA im Vergleich zu dem (nur für den Veterinärbereich zugelassenen) synthetischen, hormonell stark wirksamen Diethylstilbestrol und dem natürlichen Östradiol (Östrogen) gemäß Abb. 3, so erkennt man deutlich die wesentlichen Strukturunterschiede. Es ist die grundsätzlich andere räumliche Anordnung der polaren HO-Gruppen (blaue Doppelpfeile) in Bezug auf die gesamte Molekülachse. Denn die biologische Hormonwirkung tritt nur dann ein, wenn das Hormonmolekül nach dem Schlüssel-Schloss-Prinzip möglichst perfekt in die Proteinrezeptoren passt [2].
Einige der biologischen Studien wurden inzwischen relativiert oder müssen noch von unabhängiger Seite bestätigt werden. Aus Sicherheitsgründen hat die Europäische Union den Grenzwert für die Exposition von BPA deutlich gesenkt. Einen ausführlichen Beitrag zur Diskussion gibt es hier auf FaszinationChemie.
Das erste industriell bedeutende Polycarbonat entstand in Deutschland
Die Existenz von BPA-basiertem Polycarbonat (PC) beruht auf einer Patentlücke. Das Diol BPA wurde schon vor langer Zeit mit verschiedenen Dicarbonsäuren wie Adipinsäure oder Terephthalsäure zu Polyester umgesetzt und die Stoffe wurden patentiert. Die einfachste Säure, die Kohlensäure, war zu diesem Zeitpunkt jedoch geradezu vergessen worden. So konnte das erste industriell relevante Polycarbonat 1953 in der Gruppe von Dr. Hermann Schnell bei der Bayer AG in Krefeld Uerdingen entwickelt und sofort patentiert werden [3].
Die Synthese von Polycarbonat erfolgte ursprünglich durch Umesterung von Diphenylcarbonat, einem Derivat der Kohlensäure, mit BPA unter Freisetzung von Phenol, das recycelt wurde (Abb. 4).
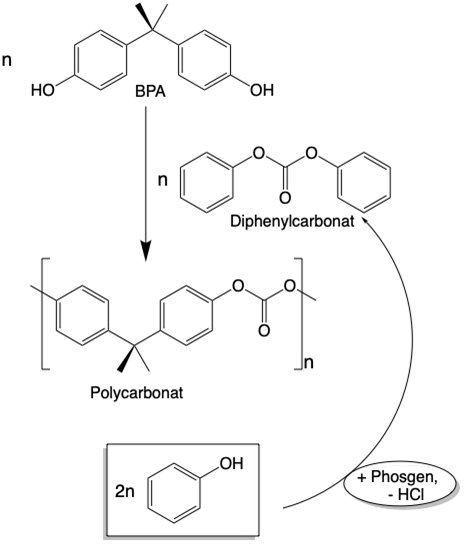
Abb. 4: Synthese von Polycarbonat (PC) aus BPA nach dem Umesterungsverfahren (Abb. H. Ritter)
Verwendung von BPA zur Herstellung von hochtransparentem und extrem schlagfestem Polycarbonat (PC)
Industriell wird heute ein direktes Phosgenverfahren zur Herstellung von Polycarbonat eingesetzt. Dabei wird Phosgen bei niedrigen Temperaturen in Methylenchlorid kondensiert, BPA-Natriumsalz in wässriger Phase zugegeben und Polycarbonat in einem Zweiphasen-Kondensationsmechanismus hergestellt. Die Besonderheit des Grenzflächenverfahrens besteht darin, dass keine 1:1-Stöchiometrie wie beim Umesterungsverfahren erforderlich ist.
Die Verwendung von Diphenylcarbonat rückt jedoch immer mehr in den Vordergrund, da dieser Kohlensäureester prinzipiell auch phosgenfrei hergestellt werden kann.
Die Carbonatfunktion im Polycarbonat kann an der Oberfläche des Materials durch heißes Wasser langsam hydrolysiert werden, wobei geringe Mengen freies BPA und CO2 entstehen können. Aus Sicherheitsgründen wurden Babyflaschen aus Polycarbonat vor einigen Jahren vom Markt genommen und durch andere Kunststoffe ersetzt.
Vielfältige Anwendungen von Polycarbonat

Abb.5: CD-Rohling aus Polycarbonat (Abb. Luis Fernández García, Interference-colors, CC BY-SA 1.0)
Da Polycarbonat relativ leicht ist, wird es gerne im Bausektor verwendet und ist oft einfacher zu verarbeiten als herkömmliche Materialien. So lassen sich beispielsweise Balkonverkleidungen oder Wintergärten sehr gut mit Polycarbonat gestalten. Auch im Automobilbau spielt Polycarbonat durch seine Transparenz und hohe Festigkeit bei relativ geringem Gewicht eine wichtige Rolle bei der Reduzierung von Kraftstoffverbrauch und Lärm. Rückleuchten, Außenspiegel und Innenverkleidungen werden häufig aus Polycarbonat hergestellt.
Bei der Herstellung von Polycarbonat für Speichermedien (CD, DVD oder BlueRay-Disc) sind niedrigere Molmassen bzw. Schmelzviskositäten erwünscht, um die Taktzeiten in der Massenproduktion zu erhöhen. In diesem Fall werden bestimmte Monophenole (z.B. p-Alkylphenol) als Endgruppen zudosiert.
Thermoplastisches Polycarbonat eignet sich aufgrund seiner hohen mechanischen Stabilität sehr gut zur Herstellung von Reisekoffern und Schutzhelmen.
Weitere Materialien auf BPA-Basis
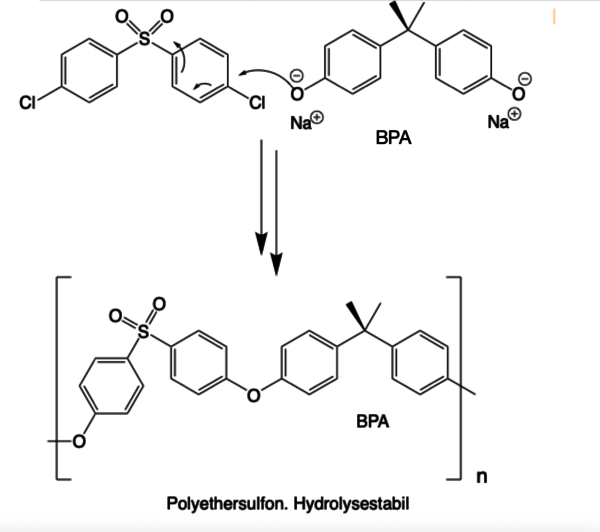
Als weiterer wichtiger Werkstoff wird Polyethersulfon aus der Umsetzung von BPA und Bis(4-chlorphenyl)sulfon gewonnen. (Abb. 6). Polyethersulfon ist ein technisch nutzbarer amorpher und transparenter Hochleistungskunststoff. Er wird zum Beispiel für thermisch hochbelastete Teile (medizinische Geräte, Automobil- und Flugzeugbau, elektrische und elektronische Komponenten) verwendet. Außerdem ist er ein wichtiges Material bei der Herstellung von Membranen zur Wasseraufbereitung und für spezielle Anwendungen, z.B: in der Dialyse [4]. Weitere Informationen zu dieser Substanzklasse gibt es in einem eigenen Beitrag hier auf FaszinationChemie.
Epoxidharze aus BPA
Epoxidharze auf BPA-Basis haben eine breite Anwendung gefunden, insbesondere in der Bau-, Elektro-, Klebstoff-, Automobil- und Flugzeugindustrie. Ohne Epoxidharze wäre eine Energiewende kaum möglich. Es handelt sich dabei um Harze mit reaktiven Epoxid-Endgruppen, die über Etherbindungen an BPA gebunden sind. Eine Hydrolyse unter Bildung von freiem BPA ist unter normalen Umweltbedingungen chemisch nicht möglich.
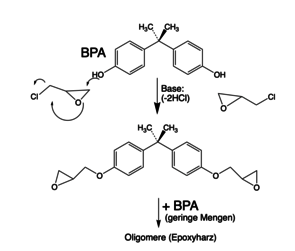
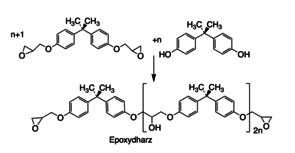
Die Synthese der Di-Epoxide erfolgt durch O-Alkylierung die phenolischen OH-Gruppen des BPA mit Epichlorhydrin. Die entstehenden Epoxide reagieren weiter mit unterschüssigem BPA unter Bildung von Oligomeren mit Epoxid-Endgruppen (Abb. 7 und 8) [5,6]. Die Härtung der Epoxidharze kann in der Kälte erfolgen, z.B. mit Diaminen (Kalthärtung) oder in der Hitze mit z.B. Säureanhydriden oder vorzugsweise mit Dicyandiamid (H2N)2C=N-CN, genannt „DICY“.
Zusammenfassung
In dieser Übersicht werden Aspekte der Verwendung und Herstellung von BPA und Folgeprodukten skizziert.
Natürlich kann dies in der Kürze nicht vollständig sein, da diese BPA-Chemie seit vielen Jahrzehnten viele Anwendungen in Alltag und Technik gefunden hat und unentbehrlich geworden ist. Inzwischen gibt es zwar viele Ersatzstoffe für BPA-Produkte. Sie unterscheiden sich jedoch im Preis und im chemisch-physikalischen Eigenschaftsprofil.
Auf die Diskussion des gesundheitlichen Aspektes wurde hier nur kurz eingegangen, da viele Untersuchungen noch nicht abgeschlossen bzw. verifiziert sind.
Ein positiver gesundheitlicher Aspekt soll jedoch hervorgehoben werden, nämlich dass Polyester aus BPA und Kohlensäure (Polycarbonat) in Form von Helmen vielen Menschen das Leben gerettet und erfolgreich vor schweren Kopfverletzungen geschützt hat.
Der Beitrag wurde vom Arbeitskreis Öffentlichkeitsarbeit der Seniorexperten Chemie, einer Fachgruppe der Gesellschaft Deutscher Chemiker, erstellt.
Autor: Prof. Dr. Dr. h.c. Helmut Ritter (bearbeitet durch kjs, Redaktion FaszinationChemie)
In unserer Rubrik „Chemie überall“ geht es um chemische Verbindungen oder chemische Verfahren, die wir im Alltag nutzen oder um Substanzen, die immer mal wieder in den Schlagzeilen sind. Die Beiträge in leicht verständlicher Form sind von Chemikerinnen und Chemikern geschrieben. Alle Beiträge der Reihe: https://faszinationchemie.de/chemie-ueberall
Quellen:
[1] Heinrich Hock, H. Kropf: Autoxydation von Kohlenwasserstoffen und die Cumol-Phenol-Synthese. In: Angewandte Chemie. 69, 1957, S. 313, doi:10.1002/ange.19570691002.
[2] Es handelt sich hier um die Ansicht des Verfassers und nicht die der Redaktion von FaszinationChemie.
[3] Hans Domininghaus (Hrsg.): Die Kunststoffe und ihre Eigenschaften. 8. Auflage, Springer-Verlag Heidelberg 2012, S. 714ff.
[4] de.wikipedia.org/wiki/Polyethersulfon

Kommentare
Keine Kommentare gefunden!